解答题-原理综合题 适中0.65 引用1 组卷140
溶液的酸碱性是影响物质性质的重要因素。
(1)常温下,现有等体积、 的
的 和
和 两种溶液,分别稀释100倍后,
两种溶液,分别稀释100倍后, 的大小关系为前者
的大小关系为前者_____ 后者(填“>”、“<”或“=”,下同)。若向两种溶液中分别加入足量锌,相同状况下产生气体体积大小关系为前者_____ 后者。若分别与 的氢氧化钠溶液等体积混合,反应后溶液的
的氢氧化钠溶液等体积混合,反应后溶液的 的大小关系为前者
的大小关系为前者_____ 后者。
(2)常温下某些弱酸和氨水的电离常数如下:
①下列反应可以发生的是___________ (填序号)。
A.
B.
C.
D.
②25℃时,将 溶液和
溶液和 溶液分别与
溶液分别与 溶液混合,画出产生的
溶液混合,画出产生的 气体体积(V)随时间(t)的变化关系图,并注明对应酸的化学式
气体体积(V)随时间(t)的变化关系图,并注明对应酸的化学式______ 。

③常温下用氨水吸收 可得到
可得到 溶液,
溶液, 溶液显
溶液显_____ (填“酸性”“中性”或“碱性”),请计算反应 的平衡常数K=
的平衡常数K=____ (保留两位有效数字)。
(1)常温下,现有等体积、
(2)常温下某些弱酸和氨水的电离常数如下:
| 化学式 | ||||||
| 电离常数 |
①下列反应可以发生的是
A.
B.
C.
D.
②25℃时,将

③常温下用氨水吸收
21-22高三上·山东泰安·期末
类题推荐
研究弱电解质的电离,有重要的实际意义。
Ⅰ. 醋酸是一种常见的有机酸。
(1)醋酸的电离方程式为__________________________________________________ 。
(2)保持温度不变,向醋酸溶液中通入一定量的氨气,下列量将变小的是________。
(3)向0.1 mol·L-1 CH3COOH溶液中加水稀释,c(CH3COO-) / c(CH3COOH)的比值将________ (填“变大”、“不变”或“变小”)。
(4)下列事实一定能说明CH3COOH是弱电解质的是____________(填字母)。
Ⅱ. 对比酸性的相对强弱
(5)现有a. CH3COOH b. HCl两种溶液,请回答下列问题(填“>”、“<”或“=”)。
① 将pH相同的两种酸溶液分别稀释100倍后,pH的大小关系为a_______ b。
② pH相同、体积相同的两种酸溶液中分别加入足量锌,相同状况下产生气体体积大小关系为a_______ b。
③ 将体积相同、pH=2的醋酸和pH=2的盐酸分别与pH=12的氢氧化钠溶液等体积混合,反应后溶液的pH的大小关系为a_______ b。
④ 相同物质的量浓度的两种酸溶液中,水的电离程度的大小关系为a_______ b。
(6)某些弱酸的电离常数如下:
①下列反应可以发生的是__________ (填字母)。
A. CH3COOH+Na2CO3=NaHCO3+CH3COONa
B. CH3COOH+NaCN=CH3COONa+HCN
C. CO2+H2O+2NaClO=Na2CO3+2HClO
D. NaHCO3+HCN=NaCN+H2O+CO2↑
②25℃时,将20 mL 1 mol·L-1 CH3COOH溶液和20 mL 1 mol·L-1 HSCN溶液分别与20 mL1 mol·L-1 NaHCO3溶液混合,画出产生的CO2气体体积(V)随时间(t)的变化关系图,并注明对应酸的化学式。__________
 。
。
Ⅰ. 醋酸是一种常见的有机酸。
(1)醋酸的电离方程式为
(2)保持温度不变,向醋酸溶液中通入一定量的氨气,下列量将变小的是________。
| A.c(CH3COO-) | B.c(H+) |
| C.c(OH-) | D.CH3COOH电离平衡常数 |
(4)下列事实一定能说明CH3COOH是弱电解质的是____________(填字母)。
| A.相同温度下,浓度均为1 mol·L-1的盐酸和醋酸的导电性对比:盐酸>醋酸 |
| B.1 mol·L-1 CH3COOH溶液能使紫色石蕊试液变红 |
| C.25℃时,1 mol·L-1 CH3COOH溶液的pH约为2 |
| D.10 mL 1mol·L-1的CH3COOH溶液恰好与10 mL 1mol·L-1 NaOH溶液完全反应 |
Ⅱ. 对比酸性的相对强弱
(5)现有a. CH3COOH b. HCl两种溶液,请回答下列问题(填“>”、“<”或“=”)。
① 将pH相同的两种酸溶液分别稀释100倍后,pH的大小关系为a
② pH相同、体积相同的两种酸溶液中分别加入足量锌,相同状况下产生气体体积大小关系为a
③ 将体积相同、pH=2的醋酸和pH=2的盐酸分别与pH=12的氢氧化钠溶液等体积混合,反应后溶液的pH的大小关系为a
④ 相同物质的量浓度的两种酸溶液中,水的电离程度的大小关系为a
(6)某些弱酸的电离常数如下:
| 化学式 | CH3COOH | HSCN | HCN | HClO | H2CO3 |
| 电 离 常 数 | 1.8×10-5 | 1.3×10-1 | 4.9×10-10 | 3.0×10-8 | K1=4.4×10-7 K2=4.7×10-11 |
A. CH3COOH+Na2CO3=NaHCO3+CH3COONa
B. CH3COOH+NaCN=CH3COONa+HCN
C. CO2+H2O+2NaClO=Na2CO3+2HClO
D. NaHCO3+HCN=NaCN+H2O+CO2↑
②25℃时,将20 mL 1 mol·L-1 CH3COOH溶液和20 mL 1 mol·L-1 HSCN溶液分别与20 mL1 mol·L-1 NaHCO3溶液混合,画出产生的CO2气体体积(V)随时间(t)的变化关系图,并注明对应酸的化学式。
 。
。 自然界是各类物质相互依存、各种变化相互制约的复杂平衡体系,水溶液中的离子平衡是其中一个重要方面。请根据所学知识,回答下列问题。
(1)某温度下,0.1mol/L的盐酸中水电离出的 ,该温度下将
,该温度下将 的NaOH溶液与
的NaOH溶液与 的
的 溶液等体积混合,混合后溶液的
溶液等体积混合,混合后溶液的
_______ 。
(2)常温下将pH均为3,体积均为 的HA和HB溶液,分别加水稀释至体积V,pH随
的HA和HB溶液,分别加水稀释至体积V,pH随 的变化如图所示。
的变化如图所示。
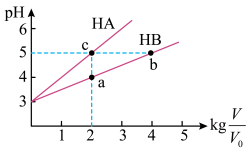
①a、b、c三点水的电离程度_______ (用“>”、“=”、“<”填空)。
②常温下,取上述pH均为3的HA和HB溶液各100mL,向其中分别加入足量的Zn粒,反应结束时HA中产生氢气的物质的量为 ,HB溶液中产生氢气的物质的量为
,HB溶液中产生氢气的物质的量为 ,则
,则
_______  (用“>”、“=”、“<”填空)。
(用“>”、“=”、“<”填空)。
(3)查阅资料获得25℃时部分弱电解质的电离平衡常数数据:
①KSCN溶液呈弱碱性,用离子方程式解释原因_______ 。
② 溶液的水解平衡常数
溶液的水解平衡常数
_______ (保留两位有效数字)。
③同浓度的NaF溶液和 溶液相比,
溶液相比,
后者溶液中
_______ 前者溶液中 (用“>”、“=”、“<”填空)。
(用“>”、“=”、“<”填空)。
④现有25℃时等浓度的5种溶液:
A. B.
B. C.
C. D.
D. E.
E.
这5种溶液中 浓度由大到小的顺序排列是:
浓度由大到小的顺序排列是:_______ (填字母)。
(1)某温度下,0.1mol/L的盐酸中水电离出的
(2)常温下将pH均为3,体积均为

①a、b、c三点水的电离程度
②常温下,取上述pH均为3的HA和HB溶液各100mL,向其中分别加入足量的Zn粒,反应结束时HA中产生氢气的物质的量为
(3)查阅资料获得25℃时部分弱电解质的电离平衡常数数据:
| 化学式 | HF | HClO | HSCN | |||
| 电离平衡常数 | 0.13 |
②
③同浓度的NaF溶液和
后者溶液中
④现有25℃时等浓度的5种溶液:
A.
这5种溶液中
回答下列问题
(1)现有a. b.HCl两种溶液,请回答下列问题(填“>”、“<”或“=”)。
b.HCl两种溶液,请回答下列问题(填“>”、“<”或“=”)。
①相同物质的量浓度的两种酸溶液中,水的电离程度的大小关系为a_________ b。
②pH相同、体积相同的两种酸溶液中分别加入足量锌,相同状况下产生气体体积大小关系为a_________ b。
将体积相同、pH=2的醋酸和pH=2的盐酸分别与pH=12的氢氧化钠溶液等体积混合,反应后溶液的pH的大小关系为a_________ b。
(2)常温下,根据表中的几种物质的电离平衡常数回答下列问题:
①下列反应不能发生的是_________ (填序号)。
a.
b.
c.
d.
②反应 的平衡常数K=
的平衡常数K=_________ 。
(3)常温下,浓度均为0.1 的下列五种钠盐溶液的pH如下表:
的下列五种钠盐溶液的pH如下表:
①上述盐溶液中的阴离子,结合 能力最强的是
能力最强的是 _________ 。
②根据表中数据,浓度均为0.01 的下列四种酸的溶液分别稀释100倍,pH变化最大的是
的下列四种酸的溶液分别稀释100倍,pH变化最大的是_________ (填编号)。
A.HCN B.HClO C. D.
D.
(4)①已知t℃时,0.01 NaOH溶液的pH=11,0.1
NaOH溶液的pH=11,0.1 的HA溶液中
的HA溶液中 。该温度下,0.1
。该温度下,0.1 HA溶液中水电离出的
HA溶液中水电离出的
_________ 。
②25℃时,将体积 、pH=a的某一元强碱与体积为
、pH=a的某一元强碱与体积为 、pH=b的某二元强酸混合。若所得溶液的pH=11,且a=13,b=2,则
、pH=b的某二元强酸混合。若所得溶液的pH=11,且a=13,b=2,则
_________ 。
③25℃时,pH=5的醋酸和pH=5的 溶液中由水电离出的
溶液中由水电离出的 浓度之比为
浓度之比为_________ 。
(1)现有a.
①相同物质的量浓度的两种酸溶液中,水的电离程度的大小关系为a
②pH相同、体积相同的两种酸溶液中分别加入足量锌,相同状况下产生气体体积大小关系为a
将体积相同、pH=2的醋酸和pH=2的盐酸分别与pH=12的氢氧化钠溶液等体积混合,反应后溶液的pH的大小关系为a
(2)常温下,根据表中的几种物质的电离平衡常数回答下列问题:
弱酸 | HClO | |||
电离平衡常数 |
a.
b.
c.
d.
②反应
(3)常温下,浓度均为0.1
溶质 | NaClO | NaCN | |||
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
②根据表中数据,浓度均为0.01
A.HCN B.HClO C.
(4)①已知t℃时,0.01
②25℃时,将体积
③25℃时,pH=5的醋酸和pH=5的
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


