解答题-实验探究题 适中0.65 引用4 组卷736
氢氧化钴[Co(OH)2]是锂电池正极材料钴酸锂(LiCoO2)的前驱体。以CoSO4溶液、NaOH溶液、氨水和水合肼为原料可制得微米级Co(OH)2。
已知:①Co2+、Co3+易与NH3形成络合物, 的还原性强于Co(OH)2和Co2+;
的还原性强于Co(OH)2和Co2+;
②水合肼(N2H4·H2O)为无色油状液体,具有强还原性,氧化产物为N2;
③沉淀的生成速率越快,颗粒越小,呈凝乳状或胶体,不易过滤。
(1)60℃时在搅拌下向CoSO4溶液中加入氨水,调节pH至6后,再加入NaOH溶液,调节pH至9.5左右,一段时间后,过滤、洗涤,真空烘干得微米级Co(OH)2。
①制备时,在加入NaOH溶液前必须先加氨水的原因是_______ 。
②洗涤时,使用热水除去产品表面杂质,检验产品是否洗净的实验操作是_______ 。
(2)经仪器分析,测得按题(1)步骤制得的Co(OH)2晶体结构中含有Co(Ⅲ),进一步用碘量法测得Co(Ⅱ)的氧化程度为8%。因此制备时必须加入一定量的还原剂。
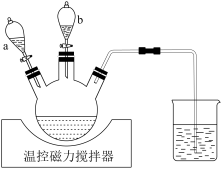
①将500 mL1 mol/L的CoSO4溶液与氨水配成pH为6的溶液,加入三颈烧瓶中(装置见如图),滴液漏斗a装有NaOH溶液、b中装有水合肼。60℃时依次将两种溶液加入三颈烧瓶,充分反应后,过滤。实验时应先打开滴液漏斗_______ (填“a”或“b”)。
②为确保制得的Co(OH)2产品中不含Co(Ⅲ),制备时至少需加入水合肼的质量为_______ g。
(3)以废旧锂电池正极材料(含LiCoO2,以及少量Al、Fe等)为原料制备微米级氢氧化钴。已知:酸性条件下的氧化性强弱顺序为:Co3+>H2O2>Cl2>Fe3+;LiOH可溶于水;下表是部分金属离子生成氢氧化物沉淀的pH。
请补充完整实验方案:取一定量废旧锂电池正极材料,粉碎后与Na2SO3溶液配成悬浊液,在搅拌下_______ ,调节pH至9.5,过滤、洗涤,真空烘干得到微米级Co(OH)2。实验中可选用的试剂:1 mol/LH2SO4溶液、2 mol/L HCl溶液、5 mol/LNaOH溶液、5 mol/L氨水、30%H2O2溶液。
已知:①Co2+、Co3+易与NH3形成络合物,
②水合肼(N2H4·H2O)为无色油状液体,具有强还原性,氧化产物为N2;
③沉淀的生成速率越快,颗粒越小,呈凝乳状或胶体,不易过滤。
(1)60℃时在搅拌下向CoSO4溶液中加入氨水,调节pH至6后,再加入NaOH溶液,调节pH至9.5左右,一段时间后,过滤、洗涤,真空烘干得微米级Co(OH)2。
①制备时,在加入NaOH溶液前必须先加氨水的原因是
②洗涤时,使用热水除去产品表面杂质,检验产品是否洗净的实验操作是
(2)经仪器分析,测得按题(1)步骤制得的Co(OH)2晶体结构中含有Co(Ⅲ),进一步用碘量法测得Co(Ⅱ)的氧化程度为8%。因此制备时必须加入一定量的还原剂。

①将500 mL1 mol/L的CoSO4溶液与氨水配成pH为6的溶液,加入三颈烧瓶中(装置见如图),滴液漏斗a装有NaOH溶液、b中装有水合肼。60℃时依次将两种溶液加入三颈烧瓶,充分反应后,过滤。实验时应先打开滴液漏斗
②为确保制得的Co(OH)2产品中不含Co(Ⅲ),制备时至少需加入水合肼的质量为
(3)以废旧锂电池正极材料(含LiCoO2,以及少量Al、Fe等)为原料制备微米级氢氧化钴。已知:酸性条件下的氧化性强弱顺序为:Co3+>H2O2>Cl2>Fe3+;LiOH可溶于水;下表是部分金属离子生成氢氧化物沉淀的pH。
| 金属离子 | Co2+ | Fe2+ | Fe3+ | Al3+ |
| 开始沉淀的pH | 7.6 | 7.6 | 2.7 | 4.0 |
| 沉淀完全的pH | 9.2 | 9.6 | 3.7 | 5.2 |
21-22高三上·江苏常州·期末
类题推荐
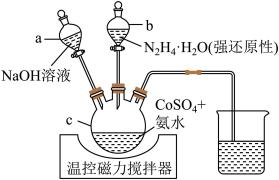
同济大学程传伟教授发现了一种高效的氮杂碳纳米片阵列负载的超薄Co(OH)2纳米片自支撑空气正极材料。实验室可用如图所示装置制得微米级Co(OH)2。
已知:①Co的化合价有+2价和+3价, 、
、 易与
易与 形成络合物,
形成络合物, 的还原性强于
的还原性强于 和
和 。
。
②沉淀的生成速率越快,颗粒越小,呈凝乳状或胶体,不易过滤。请回答下列问题:
(1)仪器 的名称是
的名称是_______ ;使用仪器 的第一步操作名称是
的第一步操作名称是_______ 。
(2) 时,先在不断搅拌下,向
时,先在不断搅拌下,向 中
中 溶液中加入氨水,调节
溶液中加入氨水,调节 至6,加入氨水的作用是
至6,加入氨水的作用是_______ 。
(3)加入氨水后,应先打开滴液漏斗_______ (填“a”或“b”);其理由是_______ 。
(4)将实验所得沉淀过滤、用热水洗涤、干燥,检验产品是否洗净的实验操作是_______ 。
(5)实验室还可以用废旧锂电池正极材料(含 ,以及少量
,以及少量 )为原料制备微米级
)为原料制备微米级 。已知:酸性条件下的氧化性强弱顺序为
。已知:酸性条件下的氧化性强弱顺序为 ;
; 可溶于水;下表是部分金属离子生成氢氧化物沉淀的
可溶于水;下表是部分金属离子生成氢氧化物沉淀的 。
。
请补充完整实验方案:取一定量废旧锂电池正极材料,粉碎后与 溶液配成悬浊液;在搅拌下,先加入
溶液配成悬浊液;在搅拌下,先加入_______ 到固体完全溶解;_______ 到溶液的颜色不再加深(或开始产生大量气泡),再向其中加入 氮水调整溶液
氮水调整溶液 ,使
,使 形成
形成 沉淀,然后过滤,除去难溶性杂质
沉淀,然后过滤,除去难溶性杂质 ;
;_______ ,调节 至9.5,过滤、洗涤,真空㤨干得到微米级
至9.5,过滤、洗涤,真空㤨干得到微米级 。[实验中可选用的试剂:
。[实验中可选用的试剂: 溶液、
溶液、 溶液、
溶液、 溶液、30%
溶液、30% 溶液]。
溶液]。
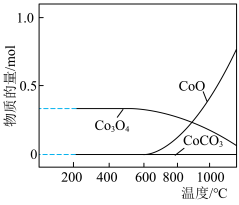
(6) 在空气中加热时,固体残留率随温度的变化如图所示,则在A点时,剩余固体的成分为
在空气中加热时,固体残留率随温度的变化如图所示,则在A点时,剩余固体的成分为_______ (填化学式)。

已知:①Co的化合价有+2价和+3价,
②沉淀的生成速率越快,颗粒越小,呈凝乳状或胶体,不易过滤。请回答下列问题:
(1)仪器
(2)
(3)加入氨水后,应先打开滴液漏斗
(4)将实验所得沉淀过滤、用热水洗涤、干燥,检验产品是否洗净的实验操作是
(5)实验室还可以用废旧锂电池正极材料(含
| 金属离子 | |||
| 开始沉淀的 | 7.6 | 7.6 | 2.7 |
| 沉淀完全的 | 9.2 | 9.6 | 3.7 |
(6)

Li2CO3可用于制备锂电池的正极材料LiCoO2,以某锂云母矿石(主要成分为Li2O,还有Al2O3、Fe2O3、MnO、MgF2等杂质)制备Li2CO3。
已知:①有关沉淀数据如下表(“完全沉淀”时金属离子浓度≤1.0×10-5mol·L-1)。
②部分物质的溶解度曲线见下图。
(1)酸浸。向锂云母矿石中加入30%硫酸,加热至90℃,装置如上图所示。烧杯中试剂的作用是_______ 。
(2)调pH。向酸浸后的溶液中加入NaOH溶液,调节pH约为6,过滤。再向滤液中继续滴加氢氧化钠溶液调pH>12,过滤,此时的滤渣主要成分为_______ 。分两次调节pH的主要原因是_______ 。
(3)沉锂。将已经除杂的溶液蒸发浓缩,向浓缩后的滤液中加入稍过量饱和Na2CO3溶液,加热煮沸,趁热过滤,将滤渣洗涤烘干,得Li2CO3固体。浓缩液中离子浓度过大将在产品中引入_______ 杂质(填化学式)。
(4)Li2CO3和Co3O4混合后,在空气中高温加热可以制备锂电池的正极材料LiCoO2,写出反应方程式:_______ 。
(5)CoC2O4·2H2O热分解可制备Co3O4.请补充完整由含c(Co2+)=0.1mol·L-1的浸出液(含有杂质Al3+、Fe3+、Fe2+)制备纯净的CoC2O4·2H2O实验方案:_______ ,干燥,得到CoC2O4·2H2O晶体。(须使用的试剂:NaClO3,NaOH,AgNO3溶液,(NH4)2C2O4,蒸馏水)
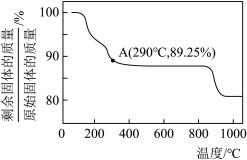
(6)为确定由CoC2O4·2H2O获得Co3O4的最佳煅烧温度,准确称取4.575g的CoC2O4·2H2O样品,在空气中加热,固体样品的剩余质量随温度的变化如图所示(已知385℃以上残留固体均为金属氧化物)。经测定,205~385℃的煅烧过程中,产生的气体为CO2,计算AB段消耗O2在标准状况下的体积_______ (写出计算过程,结果保留2位有效数字)。
已知:①有关沉淀数据如下表(“完全沉淀”时金属离子浓度≤1.0×10-5mol·L-1)。
| 沉淀 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Co(OH)2 | Mn(OH)2 | Mg(OH)2 |
| 恰好完全沉淀时pH | 5.2 | 8.8 | 3.2 | 9.4 | 9.8 | 11.1 |

(1)酸浸。向锂云母矿石中加入30%硫酸,加热至90℃,装置如上图所示。烧杯中试剂的作用是
(2)调pH。向酸浸后的溶液中加入NaOH溶液,调节pH约为6,过滤。再向滤液中继续滴加氢氧化钠溶液调pH>12,过滤,此时的滤渣主要成分为
(3)沉锂。将已经除杂的溶液蒸发浓缩,向浓缩后的滤液中加入稍过量饱和Na2CO3溶液,加热煮沸,趁热过滤,将滤渣洗涤烘干,得Li2CO3固体。浓缩液中离子浓度过大将在产品中引入
(4)Li2CO3和Co3O4混合后,在空气中高温加热可以制备锂电池的正极材料LiCoO2,写出反应方程式:
(5)CoC2O4·2H2O热分解可制备Co3O4.请补充完整由含c(Co2+)=0.1mol·L-1的浸出液(含有杂质Al3+、Fe3+、Fe2+)制备纯净的CoC2O4·2H2O实验方案:
(6)为确定由CoC2O4·2H2O获得Co3O4的最佳煅烧温度,准确称取4.575g的CoC2O4·2H2O样品,在空气中加热,固体样品的剩余质量随温度的变化如图所示(已知385℃以上残留固体均为金属氧化物)。经测定,205~385℃的煅烧过程中,产生的气体为CO2,计算AB段消耗O2在标准状况下的体积

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网