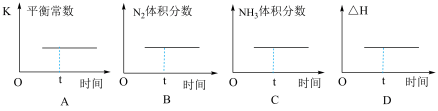
解答题-原理综合题 适中0.65 引用1 组卷161
合成氨工业结束了人类依靠天然氮肥的历史,解决了人类的粮食问题。氨气广泛应用于化肥、制药、合成纤维等领域,极大地影响了人类的发展历史。
(1)以 与
与 为原料合成尿素[CO(NH2)2]的主要反应如下:
为原料合成尿素[CO(NH2)2]的主要反应如下:
①
②
写出 与
与 合成尿素和水蒸气的热化学反应方程式
合成尿素和水蒸气的热化学反应方程式___________ 。
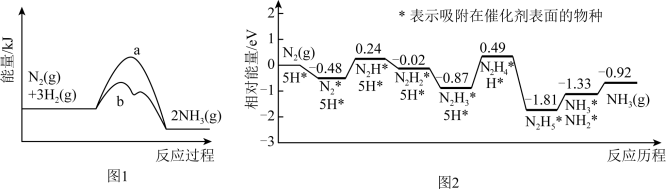
(2)工业合成氨的反应原理为 。
。 时该反应的能量变化如图1所示,图中曲线
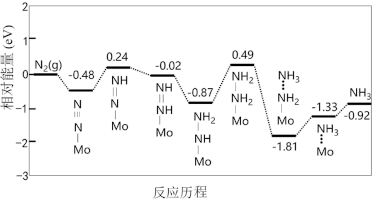
时该反应的能量变化如图1所示,图中曲线___________ (填字母)表示加入催化剂的能量变化曲线,催化剂能加快反应速率的原因是___________ 。科学工作者发现一种优良的合成氨催化剂——担载单原子钼的缺陷硼氮单层材料,反应的部分历程如图2所示,则该反应历程中需要吸收能量的最大能垒(活化能)
___________  ,对应步骤的化学方程式为
,对应步骤的化学方程式为___________ 。
(3)在实际生产中,合成氨工艺常用条件为铁触媒作催化剂、控制温度 、压强
、压强 ,原料中N2和H2的物质的量之比为1∶2.8.下列关于合成氨工艺的叙述,正确的是
,原料中N2和H2的物质的量之比为1∶2.8.下列关于合成氨工艺的叙述,正确的是___________ (填字母)。
a.平衡后再通入N2,当重新达到平衡时,N2在混合气中的体积分数减小
b.控制温度(500℃)远高于室温,是为了保证尽可能高的平衡转化率和较快的反应速率
c.分离空气得到的N2须净化处理,以防止催化剂活性降低
d.原料气中N2过量,是因为N2相对易得,适度过量有利于提高H2的转化率
(4)某化学研究性学习小组模拟工业合成氨的反应。在容积固定为2L的密闭容器内充入 和
和 ,加入合适催化剂(体积可以忽略不计)后在一定温度和压强下开始反应,并用压力计检测容器内压强随反应时间的变化如下:
,加入合适催化剂(体积可以忽略不计)后在一定温度和压强下开始反应,并用压力计检测容器内压强随反应时间的变化如下:
 时,该反应
时,该反应
_______  (填“>”、“=”或“<”),该反应的平衡常数表达式K=
(填“>”、“=”或“<”),该反应的平衡常数表达式K=_______ 。从反应开始到25min时,用H2表示的平均反应速率
_______  。
。
(1)以
①
②
写出
(2)工业合成氨的反应原理为

(3)在实际生产中,合成氨工艺常用条件为铁触媒作催化剂、控制温度
a.平衡后再通入N2,当重新达到平衡时,N2在混合气中的体积分数减小
b.控制温度(500℃)远高于室温,是为了保证尽可能高的平衡转化率和较快的反应速率
c.分离空气得到的N2须净化处理,以防止催化剂活性降低
d.原料气中N2过量,是因为N2相对易得,适度过量有利于提高H2的转化率
(4)某化学研究性学习小组模拟工业合成氨的反应。在容积固定为2L的密闭容器内充入
| 反应时间/ | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强/ | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
21-22高二上·福建漳州·期末
类题推荐
氨气广泛应用于化工、轻工、化肥、制药、合成纤维等领域,合成氨工业极大地影响了人类的发展历程。
(1)工业上用氨和二氧化碳为原料,在一定条件下合成尿素CO(NH2)2,已知:
①2NH3(g)+CO2(g)=NH2COONH4(s) ΔH = -159.5kJ/mol
②NH2COONH4(s)=CO(NH2)2(s)+H2O(g) ΔH = +116.5kJ/mol
③H2O(l)=H2O(g) ΔH = +44.0kJ/mol
写出氨气与二氧化碳生成尿素和液态水的热化学反应方程式___________ 。
(2)已知反应N2(g)+3H2(g) 2NH3(g) ΔH<0,一定温度下,将N2和H2以物质的量之比为1∶1充入盛有催化剂的密闭容器,下列图象t时刻一定处于平衡状态的是___________。
2NH3(g) ΔH<0,一定温度下,将N2和H2以物质的量之比为1∶1充入盛有催化剂的密闭容器,下列图象t时刻一定处于平衡状态的是___________。
(3)200℃时,将N2(g)和H2(g)以物质的量之比为1∶3充入恒压容器中,容器内起始压强为P0,达到平衡时N2的转化率为50%,则该反应的平衡常数KP=___________ (用含有P0的式子表示。KP为分压平衡常数,气体分压=气体总压强×该气体的体积分数)
(4)某温度下,将一定量的NH3充入盛有催化剂的恒容容器中,一段时间达到平衡后,升高温度,当再次达到平衡时,N2的分压增大,原因是___________ 。
(5)我国科学家利用密度泛函理论筛选出合成氨的优良催化剂——担载单原子钼的缺陷硼氮单层材料,反应历程如图:
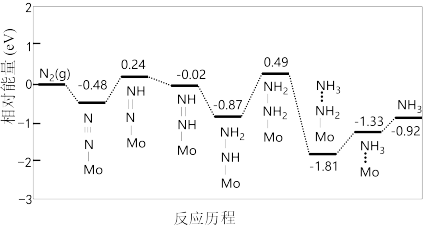
该反应历程中需要吸收能量的最大能垒(活化能)E正=___________ eV。
(6)25℃时,将2a mol/L的稀氨水与a mol/L的盐酸等体积混合后,试比较下列关系的大小(填“<”“>”或“=”):c(NH ) + c(H+)
) + c(H+)___________ c(NH3∙H2O) + c(OH-) (NH3∙H2O的Kb=1.8×10-5)
(1)工业上用氨和二氧化碳为原料,在一定条件下合成尿素CO(NH2)2,已知:
①2NH3(g)+CO2(g)=NH2COONH4(s) ΔH = -159.5kJ/mol
②NH2COONH4(s)=CO(NH2)2(s)+H2O(g) ΔH = +116.5kJ/mol
③H2O(l)=H2O(g) ΔH = +44.0kJ/mol
写出氨气与二氧化碳生成尿素和液态水的热化学反应方程式
(2)已知反应N2(g)+3H2(g)
A. | B. |
C. | D. |
(4)某温度下,将一定量的NH3充入盛有催化剂的恒容容器中,一段时间达到平衡后,升高温度,当再次达到平衡时,N2的分压增大,原因是
(5)我国科学家利用密度泛函理论筛选出合成氨的优良催化剂——担载单原子钼的缺陷硼氮单层材料,反应历程如图:

该反应历程中需要吸收能量的最大能垒(活化能)E正=
(6)25℃时,将2a mol/L的稀氨水与a mol/L的盐酸等体积混合后,试比较下列关系的大小(填“<”“>”或“=”):c(NH
德国科学家哈伯在1905年发明了合成氨的方法,开辟了人工固氮的重要途径,解决了亿万人口生存问题。其合成原理为:N2(g)+3H2(g) 2NH3(g)△H=-92.4kJ·mol-1,请回答下列问题:
2NH3(g)△H=-92.4kJ·mol-1,请回答下列问题:
(1)某化学研究性学习小组模拟工业合成氨的反应。在容积固定为2L的密闭容器内充入1molN2和3molH2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下表:
则从反应开始到25min时,以H2表示的平均反应速率为_______ 。
(2)合成氨反应N2(g)+3H2(g) 2NH3(g),初始时氮气、氢气的体积比为1:3,在相同催化剂条件下平衡混合物中氨的体积分数φ(NH3)与温度、压强的关系如图所示。
2NH3(g),初始时氮气、氢气的体积比为1:3,在相同催化剂条件下平衡混合物中氨的体积分数φ(NH3)与温度、压强的关系如图所示。

①A、B两点化学反应速率:v逆(A)_______ v逆(B) (填“>”、“=”、“<”)。
②在C点时,N2的转化率为_______ 。
(3)随着温度升高,单位时间内NH3的产率增大,温度高于900°C以后,单位时间内NH3的产率开始下降的原因可能是:升高温度催化剂活性降低;_______ 。
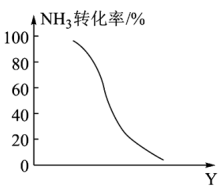
(4)工业上利用氨气生产氢氰酸的反应为:NH3(g)+CH4(g) 3H2(g)+HCN(g) ΔH>0,在其他条件一定,该反应达到平衡时NH3转化率随外界条件Y变化的关系如图所示,Y代表_______(填字母代号)。
3H2(g)+HCN(g) ΔH>0,在其他条件一定,该反应达到平衡时NH3转化率随外界条件Y变化的关系如图所示,Y代表_______(填字母代号)。
(5)工业合成氨反应为:N2(g)+3H2(g) 2NH3(g),当进料体积比V(N2):V(H2)=1:3时,平衡气体中NH3的物质的量分数随温度和压强变化的关系如图所示:500°C、压强为10P0时,Kp=
2NH3(g),当进料体积比V(N2):V(H2)=1:3时,平衡气体中NH3的物质的量分数随温度和压强变化的关系如图所示:500°C、压强为10P0时,Kp=_______ [Kp为平衡分压代替平衡浓度计算求得的平衡常数(分压=总压×物质的量分数),用P0的代数式表示]。

(1)某化学研究性学习小组模拟工业合成氨的反应。在容积固定为2L的密闭容器内充入1molN2和3molH2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下表:
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
则从反应开始到25min时,以H2表示的平均反应速率为
(2)合成氨反应N2(g)+3H2(g)

①A、B两点化学反应速率:v逆(A)
②在C点时,N2的转化率为
(3)随着温度升高,单位时间内NH3的产率增大,温度高于900°C以后,单位时间内NH3的产率开始下降的原因可能是:升高温度催化剂活性降低;
(4)工业上利用氨气生产氢氰酸的反应为:NH3(g)+CH4(g)

| A.原料中CH4与NH3的体积比 | B.温度 | C.压强 | D.催化剂 |

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网