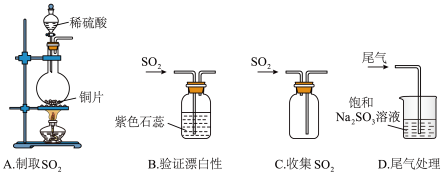
解答题-实验探究题 适中0.65 引用2 组卷508
I.为观察铜和浓硫酸的反应现象并探究SO2与Fe3+之间的氧化还原反应,某化学兴趣小组按下图装置进行实验(夹持、加热仪器已略去)。同学们查阅资料后了解,浓硫酸(常规质量分数为98.3%,密度为1.84 g/cm3)的沸点为338℃,加热过程中可能产生酸雾。请回答下列问题:
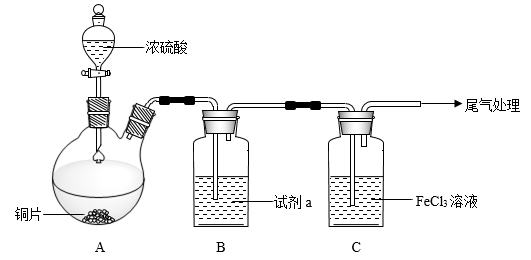
(1)搭建好实验装置后,紧接着要进行的一步操作是_____ ;试剂a是______ ;
(2)写出装置A中反应的化学方程式______ ;
(3)对于上述实验描述正确的是_____(填序号);
(4)SO2气体通入C装置充分反应,请设计实验证明氧化产物中阴离子的存在_____ 。
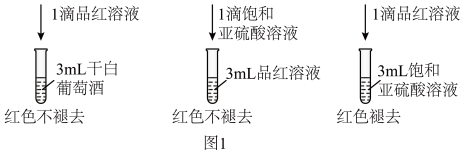
II.我国国家标准规定葡萄酒中的最大使用量为0.25 g/L。该小组测定某干白葡萄酒中的的含量(以游离计),将200 mL葡萄酒和足量盐酸共热,使全部逸出并与H2O2完全反应,除去过量的H2O2后,与0.0600 mol/LNaOH标准溶液反应,恰好消耗NaOH溶液20.00 mL,请回答:
(5)该葡萄酒中SO2的含量为_____  ,该测定结果比实际值偏高,原因是
,该测定结果比实际值偏高,原因是______ 。

(1)搭建好实验装置后,紧接着要进行的一步操作是
(2)写出装置A中反应的化学方程式
(3)对于上述实验描述正确的是_____(填序号);

| A.在加热条件下充分反应,A装置烧瓶中溶液呈蓝色 |
| B.C中溶液酸性增强,说明SO2与Fe3+之间发生了氧化还原反应 |
| C.向C中加入几滴KMnO4溶液,紫红色褪去,说明C溶液中生成了Fe2+ |
| D.尾气处理可以选择如上图装置 |
II.我国国家标准规定葡萄酒中的最大使用量为0.25 g/L。该小组测定某干白葡萄酒中的的含量(以游离计),将200 mL葡萄酒和足量盐酸共热,使全部逸出并与H2O2完全反应,除去过量的H2O2后,与0.0600 mol/LNaOH标准溶液反应,恰好消耗NaOH溶液20.00 mL,请回答:
(5)该葡萄酒中SO2的含量为
21-22高一上·浙江宁波·期末
类题推荐
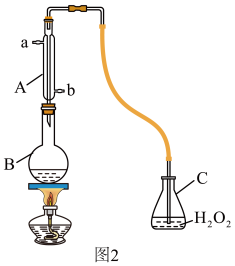
I.为观察铜和浓硫酸的反应现象并探究SO2的性质,某化学兴趣小组按下图装置进行实验(夹持、加热仪器已略去)。同学们查阅资料后了解,浓硫酸(常规质量分数为98.3%,密度为1.84g/cm3)的沸点为338°C,加热过程中可能产生酸雾。请回答下列问题:
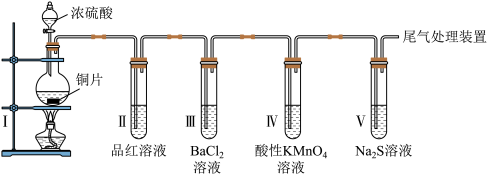
(1)装置I中盛放浓硫酸的仪器名称是_______ ,其中发生反应的化学方程式为_______ 。
(2)下列说法正确的是_______。
(3)取下试管III并不断振荡,试管中出现浑浊,请用化学方程式解释其原因_______ 。
(4)取下试管II,在该试管口套上气球,将无色溶液加热恢复至红色,冷却后,发现溶液颜色再次变浅。解释“无色→红色→颜色变浅”变化的原因_______ 。
II.我国国家标准规定葡萄酒中的二氧化硫最大使用量为0.25g/L。该小组测定某干白葡萄酒中的的含硫量(以游离态计),将100mL葡萄酒和足量盐酸共热,使全部逸出并与H2O2完全反应,除去过量的H2O2后,与0.00300mol/LNaOH标准溶液反应,恰好消耗NaOH溶液20.00mL,请回答:
(5)该葡萄酒中SO2的含量为_______ g/L。该测定结果比实际值偏高,原因是_______ 。

(1)装置I中盛放浓硫酸的仪器名称是
(2)下列说法正确的是_______。
| A.反应后,将水加入装置I的圆底烧瓶中,溶液呈蓝色 |
| B.试管IV中KMnO4溶液褪色,说明SO2具有还原性 |
| C.试管V中产生淡黄色沉淀,是因为Na2S氧化了SO2产生S沉淀 |
| D.实验尾气可用Na2CO3溶液处理 |
(4)取下试管II,在该试管口套上气球,将无色溶液加热恢复至红色,冷却后,发现溶液颜色再次变浅。解释“无色→红色→颜色变浅”变化的原因
II.我国国家标准规定葡萄酒中的二氧化硫最大使用量为0.25g/L。该小组测定某干白葡萄酒中的的含硫量(以游离态计),将100mL葡萄酒和足量盐酸共热,使全部逸出并与H2O2完全反应,除去过量的H2O2后,与0.00300mol/LNaOH标准溶液反应,恰好消耗NaOH溶液20.00mL,请回答:
(5)该葡萄酒中SO2的含量为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网