解答题-工业流程题 较难0.4 引用2 组卷225
磁选后的炼铁高钛炉渣,主要成分有TiO2、SiO2、Al2O3、MgO、CaO以及少量的Fe2O3。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。“焙烧”中,TiO2、SiO2几乎不发生反应,MgO、CaO、Fe2O3转化为相应的硫酸盐,Al2O3转化为NH4A1(SO4)2。
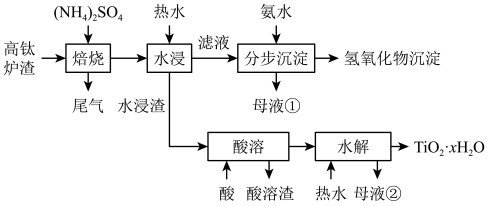
该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表
回答下列问题:
(1)“水浸”后“滤液”的pH约为2.0,在“分步沉淀”时用氨水逐步调节pH至11.6,依次析出的金属离子是___________ ,该“ 母液①”中Mg2+浓度为___________ mol·L-1。
(2)“酸溶”后,将溶液适当稀释并加热,TiO2+水解析出TiO2·xH2O沉淀,该反应的离子方程式是___________ ,将溶液稀 释的原因是___________ 。
(3)分离出的Mg(OH)2沉淀可经如下处理得到金属镁:
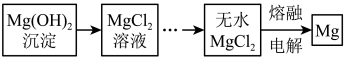
从MgCl2溶液中获取无水MgCl2通常需要通入HCl气体,HCl气体的作用是___________ ; 如果用惰性电极直接电解MgCl2溶液则得不到金属镁,电解MgCl2溶液的总反应方程式为:___________ 。
(4)用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜,电解质溶液一般为H2SO4-H2C2O4混合溶液。阳极的电极反应式为___________ 。
(5)CaSO4是锅炉水垢的成分之一,试从沉淀溶解平衡的角度解释盐酸能溶解CaCO3而不能溶解CaSO4的原因___________ 。

该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表
| 金属离子 | Fe3+ | Al3+ | Mg2+ | Ca2+ |
| 开始沉淀的pH | 2.2 | 3.7 | 9.5 | 12.4 |
| 沉淀完全(c=1.0 ×10-5 mol ·L-1)的pH | 3.2 | 4.7 | 11.1 | 13.8 |
(1)“水浸”后“滤液”的pH约为2.0,在“分步沉淀”时用氨水逐步调节pH至11.6,依次析出的金属离子是
(2)“酸溶”后,将溶液适当稀释并加热,TiO2+水解析出TiO2·xH2O沉淀,该反应的离子方程式是
(3)分离出的Mg(OH)2沉淀可经如下处理得到金属镁:

从MgCl2溶液中获取无水MgCl2通常需要通入HCl气体,HCl气体的作用是
(4)用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜,电解质溶液一般为H2SO4-H2C2O4混合溶液。阳极的电极反应式为
(5)CaSO4是锅炉水垢的成分之一,试从沉淀溶解平衡的角度解释盐酸能溶解CaCO3而不能溶解CaSO4的原因
21-22高二上·山西太原·期末
类题推荐
磁选后的炼铁高钛炉渣,主要成分有TiO2、SiO2、Al2O3、MgO、CaO以及少量的Fe2O3。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。

该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表。回答下列问题:
(1)“焙烧”中,TiO2、SiO2几乎不发生反应,Al2O3、MgO、CaO、Fe2O3转化为相应的硫酸盐,写出MgO与(NH4)2SO4反应的化学方程式___________ 。
(2)“水浸”后“滤液”的pH约为2.0,在“分步沉淀”时用氨水逐步调节pH至11.6,最后沉淀的金属阳离子是___________ (填离子符号)。
(3)“分步沉淀”用氨水比用NaOH的优点是___________ 、___________ 。(写出两点)
(4)“水浸渣”“酸溶”的温度是160°C,TiO2溶于酸生成的阳离子是TiO2+,写出该反应的化学方程式___________ 。
(5)“酸溶“后,将溶液适当稀释并加热,水解析出TiO2·xH2O沉淀,稀释并加热的目的是___________ 。
(6)将“母液①”和“母液②”混合,吸收尾气,经处理得___________ (填化学式),循环利用。

该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表。回答下列问题:
| 金属离子 | Fe3+ | Al3+ | Mg2+ | Ca2+ |
| 开始沉淀的pH | 2.2 | 3.5 | 9.5 | 12.4 |
| 沉淀完全(c=1.0×10-5mol·L-1)的pH | 3.2 | 4.7 | 11.1 | 13.8 |
(2)“水浸”后“滤液”的pH约为2.0,在“分步沉淀”时用氨水逐步调节pH至11.6,最后沉淀的金属阳离子是
(3)“分步沉淀”用氨水比用NaOH的优点是
(4)“水浸渣”“酸溶”的温度是160°C,TiO2溶于酸生成的阳离子是TiO2+,写出该反应的化学方程式
(5)“酸溶“后,将溶液适当稀释并加热,水解析出TiO2·xH2O沉淀,稀释并加热的目的是
(6)将“母液①”和“母液②”混合,吸收尾气,经处理得
磁选后的炼铁高钛炉渣,主要成分有TiO2、SiO2、Al2O3、MgO、CaO以及少量的Fe2O3。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
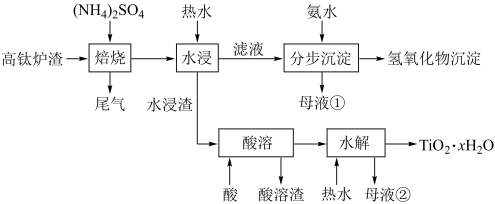
该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表,回答下列问题:
(1)“焙烧”中,TiO2、SiO2几乎不发生反应,Al2O3、MgO、CaO、Fe2O3转化为相应的硫酸盐,Al2O3转化为NH4Al(SO4)2,写出向NH4Al(SO4)2中加入过量氨水的离子方程式:___________ 。
(2)pH约为2.0,在“分步沉淀时用氨水逐步调节pH至11.6,其中使Fe3+、Al3+完全沉淀的pH值范围:___________ 。
(3)根据表中信息,计算Mg(OH)2 的Ksp=___________ 。
(4)“水浸渣”在160℃ “酸溶”最适合的酸是___________ 。“酸溶渣”的成分是___________ 、___________ 。
(5)“酸溶”后,将溶液适当稀释并加热,TiO2+水解析出TiO2·xH2O沉淀,该反应的离子方程式是:___________ 。
(6)将“母液①”和“母液②”混合,吸收尾气,经处理得___________ ,循环利用。

该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表,回答下列问题:
| 金属离子 | Fe3+ | Al3+ | Mg2+ | Ca2+ |
| 开始沉淀的pH | 2.2 | 3.5 | 9.5 | 12.4 |
| 沉淀完全(c=1.0×10-5mol·L-1)的pH | 3.2 | 4.7 | 11.0 | 13.8 |
(1)“焙烧”中,TiO2、SiO2几乎不发生反应,Al2O3、MgO、CaO、Fe2O3转化为相应的硫酸盐,Al2O3转化为NH4Al(SO4)2,写出向NH4Al(SO4)2中加入过量氨水的离子方程式:
(2)pH约为2.0,在“分步沉淀时用氨水逐步调节pH至11.6,其中使Fe3+、Al3+完全沉淀的pH值范围:
(3)根据表中信息,计算Mg(OH)2 的Ksp=
(4)“水浸渣”在160℃ “酸溶”最适合的酸是
(5)“酸溶”后,将溶液适当稀释并加热,TiO2+水解析出TiO2·xH2O沉淀,该反应的离子方程式是:
(6)将“母液①”和“母液②”混合,吸收尾气,经处理得
磁选后的炼铁高钛炉渣,主要成分有TiO2、SiO2、Al2O3、MgO、CaO、Fe2O3以及少量的Fe2O3。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。

该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表,回答下列问题:
(1)“焙烧”中,TiO2、SiO2几乎不发生反应,Al2O3、MgO、CaO、Fe2O3转化为相应的硫酸盐,Al2O3转化为NH4Al(SO4)2,写出向NH4Al(SO4)2中加入过量氨水的离子方程式:___________ 。
(2)“水浸”后滤液的pH约为2.0,在“分步沉淀时用氨水逐步调节pH至11.6,其中使Fe3+、Al3+完全沉淀的pH值范围:___________
(3)根据表中信息,计算Mg(OH)2 的Ksp=___________
(4)“水浸渣”在160℃“酸溶”最适合的酸是___________ 。“酸溶渣”的成分是___________ 、___________ 。
(5)“酸溶”后,将溶液适当稀释并加热,TiO2+水解析出TiO2·xH2O沉淀,该反应的离子方程式是:___________ 。
(6)将“母液①”和“母液②”混合,吸收尾气,经处理得___________ ,循环利用。

该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表,回答下列问题:
| 金属离子 | Fe3+ | Al3+ | Mg2+ | Ca2+ |
| 开始沉淀的pH | 2.2 | 3.5 | 9.5 | 12.4 |
| 沉淀完全(c=1×10-5mol/L)的pH | 3.2 | 4.7 | 11.0 | 13.8 |
(1)“焙烧”中,TiO2、SiO2几乎不发生反应,Al2O3、MgO、CaO、Fe2O3转化为相应的硫酸盐,Al2O3转化为NH4Al(SO4)2,写出向NH4Al(SO4)2中加入过量氨水的离子方程式:
(2)“水浸”后滤液的pH约为2.0,在“分步沉淀时用氨水逐步调节pH至11.6,其中使Fe3+、Al3+完全沉淀的pH值范围:
(3)根据表中信息,计算Mg(OH)2 的Ksp=
(4)“水浸渣”在160℃“酸溶”最适合的酸是
(5)“酸溶”后,将溶液适当稀释并加热,TiO2+水解析出TiO2·xH2O沉淀,该反应的离子方程式是:
(6)将“母液①”和“母液②”混合,吸收尾气,经处理得
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


