解答题-工业流程题 0.65 引用1 组卷130
铝渣主要成分为Al2O3,含少量Fe3O4、CuO、PbCO3、MnCO3。 以铝渣为原料制备半导体AlN的基本工艺流程如下图所示。
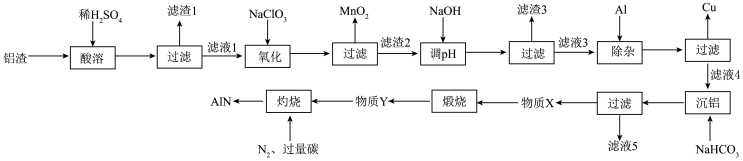
已知:I.“酸溶”时铝渣中金属元素的化合价均未发生变化。
II.“氧化”时锰以及部分铁元素化合价发生了变化。
回答下列问题:
(1)能够加快“酸溶”速率的措施有___________ (答一 条即可), 滤渣1的主要成分是___________ (填化学式) 。
(2)“氧化”时生成MnO2的离子方程式为___________ ;若 “氧化”过程中溶液中n(H+)未变,则铝渣中Fe3O4与MnCO3的物质的量之比为___________ 。
(3)常温下,Ksp[Al(OH)3] =4.0 ×10-33。“氧化” 后滤液2中c(Al3+)= 0.1 mol·L-1,若将滤液2的pH调至3.5,___________ (填 “会”或“不会”)产生Al(OH)3沉淀。
(4)“沉铝”时,反应的离子方程式为____________ ,写出该反应的一个用途___________ 。
(5)“灼烧”时得到AlN的化学方程式为___________ ; 该过程反应后期需通入一定量的空气,其目的是___________ (从提高 AlN纯度角度考虑)。

已知:I.“酸溶”时铝渣中金属元素的化合价均未发生变化。
II.“氧化”时锰以及部分铁元素化合价发生了变化。
回答下列问题:
(1)能够加快“酸溶”速率的措施有
(2)“氧化”时生成MnO2的离子方程式为
(3)常温下,Ksp[Al(OH)3] =4.0 ×10-33。“氧化” 后滤液2中c(Al3+)= 0.1 mol·L-1,若将滤液2的pH调至3.5,
(4)“沉铝”时,反应的离子方程式为
(5)“灼烧”时得到AlN的化学方程式为
21-22高三上·山东日照·阶段练习


