解答题-工业流程题 适中0.65 引用3 组卷155
某工厂利用制革工业污泥[含Cr(III)]制取CrOH(H2O)5SO4的工艺流程如下:
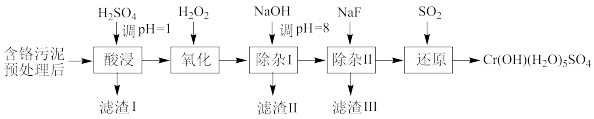
已知:酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+等。
(1)酸浸时,为了提高浸取率可采取的措施有_______ 。
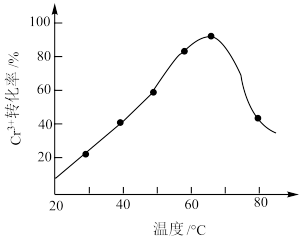
(2)H2O2的作用是将滤液中的Cr3+转化为Cr2O ,控制其他条件不变,在相同时间内,测得温度对Cr3+转化率的影响如图所示。请分析温度超过70°C时,Cr3+转化率下降的原因是
,控制其他条件不变,在相同时间内,测得温度对Cr3+转化率的影响如图所示。请分析温度超过70°C时,Cr3+转化率下降的原因是_______ 。
(3)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
①滤渣II的主要成分为_______ (填化学式)。
②用NaOH调节溶液的pH不能超过8,其理由是_______ 。
(4)在“除杂II”中,当溶液中镁离子和钙离子沉淀完全时,所得溶液中 =
=_______ 。(已知:Ksp(CaF2)=1.48×10-10,Ksp(MgF2)=7.40×10-11)
(5)上述流程中,加入NaOH溶液后,溶液呈碱性,Cr2O 气转化为CrO
气转化为CrO ,写出上述流程中的“还原”过程生成CrOH(H2O)5SO4沉淀的离子方程式
,写出上述流程中的“还原”过程生成CrOH(H2O)5SO4沉淀的离子方程式_______ 。

已知:酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+等。
(1)酸浸时,为了提高浸取率可采取的措施有
(2)H2O2的作用是将滤液中的Cr3+转化为Cr2O

(3)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
| 阳离子 | Fe3+ | Al3+ | Mg2+ | Ca2+ |
| 开始沉淀时的pH | 1.5 | 3.4 | 8.9 | 11.9 |
| 沉淀完全时的pH | 2.8 | 4.7(>8溶解) | 10.9 | 14 |
②用NaOH调节溶液的pH不能超过8,其理由是
(4)在“除杂II”中,当溶液中镁离子和钙离子沉淀完全时,所得溶液中
(5)上述流程中,加入NaOH溶液后,溶液呈碱性,Cr2O
21-22高二上·湖南永州·期末
类题推荐
利用化学原理可以对工厂排放的废水,废渣等进行有效检测与合理处理。某工厂对制革工业污泥中部的处理工艺流程如下:
(1)酸浸时,为了提高浸取率可采取的措施有_________ 、___________ 。(答出两点)。
(2)H2O2的作用是将滤液I中的Cr3+转化为 ,则此反应中氧化剂和还原剂物质的量之比为
,则此反应中氧化剂和还原剂物质的量之比为_______ 。
(3)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
①用NaOH调节溶液的pH不能超过8,其理由是________________ 。
②当pH=8时,Mg2+是否开始沉淀(溶液中镁离子浓度不超过1 mol·L-1)。____ (填“是”或“否”(已知Ksp[Mg(OH)2]=1. 8×10-11)。
(4)上述流程中,加入NaOH 溶液后,溶液呈碱性, 转化为
转化为 ,写出上述流程中用SO2进行还原时发生反应的离子方程式
,写出上述流程中用SO2进行还原时发生反应的离子方程式_____________ 。

(1)酸浸时,为了提高浸取率可采取的措施有
(2)H2O2的作用是将滤液I中的Cr3+转化为
(3)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
| 阳离子 | Fe3+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | — | — |
| 沉淀完全时的pH | 3.7 | 5.4(>8溶解) | 9(>9溶解) |
②当pH=8时,Mg2+是否开始沉淀(溶液中镁离子浓度不超过1 mol·L-1)。
(4)上述流程中,加入NaOH 溶液后,溶液呈碱性,
利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下:

已知:酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+等。
(1)配制500mL4.8mol/L的稀硫酸溶液,需要的玻璃仪器除烧杯、玻璃棒外,还需要______ 。
(2)酸浸时,为了提高浸取率可采取的措施有________ 、________ 。(答出两点)
(3)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O ,则此反应中氧化剂和还原剂的物质的量之比为
,则此反应中氧化剂和还原剂的物质的量之比为________ 。控制其他条件不变,反应温度对Cr3+转化率的影响如图所示。请分析温度超过70 ℃时,Cr3+转化率下降的原因是__________ 。

(4)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
①用NaOH调节溶液的pH不能超过8,其理由是_________ 。
②当pH=8时,Mg2+是否开始沉淀(溶液中镁离子浓度约为1 mol·L-1)________ (填 “是”或“否”)。已知Ksp[Mg(OH)2]=1.8×10-11。
(5)上述流程中,加入NaOH溶液后,溶液呈碱性,Cr2O72-转化为CrO42-,写出上述流程中用SO2进行还原反应生成CrOH(H2O)5SO4沉淀的离子方程式_________ 。
(6)Cr(OH)3和Al(OH)3类似,也是两性氢氧化物,写出向CrCl3溶液中逐滴加NaOH溶液至过量的离子方程式_____________ 。

已知:酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+等。
(1)配制500mL4.8mol/L的稀硫酸溶液,需要的玻璃仪器除烧杯、玻璃棒外,还需要
(2)酸浸时,为了提高浸取率可采取的措施有
(3)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O
 ,则此反应中氧化剂和还原剂的物质的量之比为
,则此反应中氧化剂和还原剂的物质的量之比为
(4)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
| 阳离子 | Fe3+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | — | — |
| 沉淀完全时的pH | 3.7 | 5.4(>8溶解) | 9(>9溶解) |
①用NaOH调节溶液的pH不能超过8,其理由是
②当pH=8时,Mg2+是否开始沉淀(溶液中镁离子浓度约为1 mol·L-1)
(5)上述流程中,加入NaOH溶液后,溶液呈碱性,Cr2O72-转化为CrO42-,写出上述流程中用SO2进行还原反应生成CrOH(H2O)5SO4沉淀的离子方程式
(6)Cr(OH)3和Al(OH)3类似,也是两性氢氧化物,写出向CrCl3溶液中逐滴加NaOH溶液至过量的离子方程式
某工厂对制革工业污泥Cr(Ⅲ)的处理工艺流程如图:
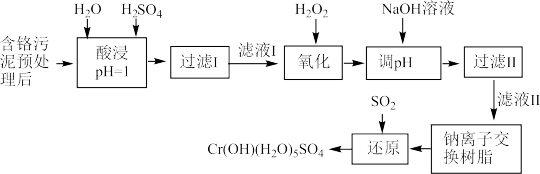
已知硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)酸浸时,为了提高反应速率可采取的措施有_______ 、_______ 、_______ 。
(2)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O ,则此反应中还原产物为
,则此反应中还原产物为_______ 。
(3)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如表所示:
用NaOH调节溶液的pH范围是_______ 、“过滤II”时滤渣的主要成分是_______ 。
(4)使用“钠离子交换树脂”的目的是_______ 。
(5)上述流程中,加入NaOH溶液后,溶液呈碱性,Cr2O 转化为CrO
转化为CrO ,写出上述流程中用SO2进行还原时发生反应的离子方程式:
,写出上述流程中用SO2进行还原时发生反应的离子方程式:_______ 。

已知硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)酸浸时,为了提高反应速率可采取的措施有
(2)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O
(3)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如表所示:
| 阳离子 | Fe3+ | Al3+ | Cr3+ | Mg2+ |
| 开始沉淀时的pH | 2.7 | - | - | 9.1 |
| 沉淀完全时的pH | 3.7 | 5.4(>8溶解) | 9(>9溶解) | 11.1 |
(4)使用“钠离子交换树脂”的目的是
(5)上述流程中,加入NaOH溶液后,溶液呈碱性,Cr2O
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


