解答题-原理综合题 适中0.65 引用1 组卷100
二氧化锰和高锰酸钾是重要的化学用品
文献资料:K2MnO4为暗绿色固体,在强碱性溶液中稳定,在中性或酸性溶液中易发生歧化反应(Mn的化合价既升高又降低)。
Ⅰ.用软锰矿吸收含SO2的废气,制备高纯度的硫酸锰晶体
已知:①
②
③
(1)固体MnO2和SO2(g)反应生成MnSO4固体的热化学方程式为___________ 。
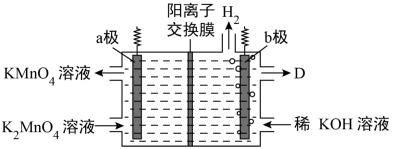
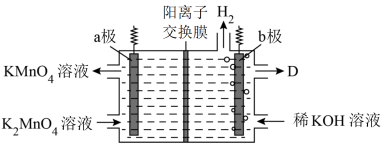
Ⅱ.工业上常用软锰矿(主要成分MnO2)为原料制备高锰酸钾。其方法为:将软锰矿(主要成分MnO2)充分粉碎后与KOH固体混合,通入空气充分焙烧,生成暗绿色熔融态物质。冷却,将固体研细,用稀KOH溶液浸取,过滤,得暗绿色溶液(主要成分为K2MnO4)。再将K2MnO4溶液采用惰性电极隔膜法电解,制得KMnO4。
(2)软锰矿与KOH固体混合焙烧前充分粉碎的原因是___________ 。
(3)焙烧时发生反应的化学方程式为___________ 。
(4)固体研细后用稀KOH溶液浸取的原因是___________ 。
(5)用惰性电极隔膜法电解K2MnO4溶液的装置为如下:
①a极的电极反应为___________ 。
②研究发现,用无膜法电解时,锰元素利用较低,其原因是___________ 。
Ⅲ.测定KMnO4产品的纯度
(6)测定KMnO4产品的纯度可用标准Na2SO3溶液滴定。
①取某KMnO4产品0.5000g溶于水,并加入___________ (填字母)进行酸化。
A.稀盐酸 B.稀硫酸 C.硝酸 D.次氯酸
②所得溶液用0.2000 mol/L标准Na2SO3溶液进行滴定,滴定至终点记录实验消耗Na2SO3溶液的体积。
重复步骤①②,三次平行实验数据如表:
(有关离子方程式为 )
)
计算该KMnO4 (式量为:158)产品的纯度为___________ (结果保留三位有效数字)。
文献资料:K2MnO4为暗绿色固体,在强碱性溶液中稳定,在中性或酸性溶液中易发生歧化反应(Mn的化合价既升高又降低)。
Ⅰ.用软锰矿吸收含SO2的废气,制备高纯度的硫酸锰晶体
已知:①
②
③
(1)固体MnO2和SO2(g)反应生成MnSO4固体的热化学方程式为
Ⅱ.工业上常用软锰矿(主要成分MnO2)为原料制备高锰酸钾。其方法为:将软锰矿(主要成分MnO2)充分粉碎后与KOH固体混合,通入空气充分焙烧,生成暗绿色熔融态物质。冷却,将固体研细,用稀KOH溶液浸取,过滤,得暗绿色溶液(主要成分为K2MnO4)。再将K2MnO4溶液采用惰性电极隔膜法电解,制得KMnO4。
(2)软锰矿与KOH固体混合焙烧前充分粉碎的原因是
(3)焙烧时发生反应的化学方程式为
(4)固体研细后用稀KOH溶液浸取的原因是
(5)用惰性电极隔膜法电解K2MnO4溶液的装置为如下:

①a极的电极反应为
②研究发现,用无膜法电解时,锰元素利用较低,其原因是
Ⅲ.测定KMnO4产品的纯度
(6)测定KMnO4产品的纯度可用标准Na2SO3溶液滴定。
①取某KMnO4产品0.5000g溶于水,并加入
A.稀盐酸 B.稀硫酸 C.硝酸 D.次氯酸
②所得溶液用0.2000 mol/L标准Na2SO3溶液进行滴定,滴定至终点记录实验消耗Na2SO3溶液的体积。
重复步骤①②,三次平行实验数据如表:
| 实验次数 | 1 | 2 | 3 |
| 消耗 | 19.30 | 20.98 | 21.02 |
(有关离子方程式为
计算该KMnO4 (式量为:158)产品的纯度为
21-22高二上·北京顺义·期末
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网