解答题-原理综合题 适中0.65 引用1 组卷84
回答下列问题
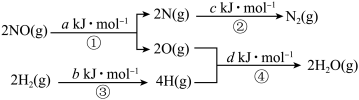
(1)工业合成氨的反应为: 。已知在298 K时,
。已知在298 K时, ,
,
①根据反应的焓变和熵变,分析在298 K时合成氨反应___________ (填“能”、“不能”或“无法判断”)正向自发进行。
②有利于化学平衡向生成氨的方向移动的是___________ 。
A.升高温度,增大压强 B.升高温度,减小压强
C.降低温度,减小压强 D.降低温度,增大压强
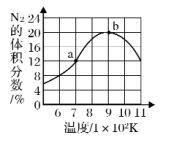
③下图为合成氨生产设备流程示意图,下列说法错误的是___________
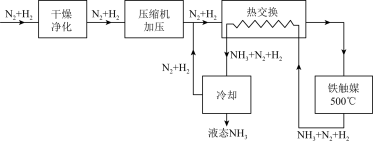
A.为防止原料气中混有的杂质使催化剂“中毒”而丧失催化活性,原料气必须经过净化
B.压缩机加压过程,既要考虑平衡移动的问题,又要考虑加压对设备材料的强度设备的制造要求的问题
C.合成氨反应的温度控制在500℃左右,此温度下反应物的平衡转化率最大
D.冷却过程,及时将 从平衡混合物中分离除去,促使合成氨反应向生成氨气的方向移动
从平衡混合物中分离除去,促使合成氨反应向生成氨气的方向移动
④假设在恒温恒容的密闭容器中,通入2 mol 、6 mol
、6 mol 以及4 molAr,达平衡时,氮气的转化率为50%,平衡总压为20MPa,计算平衡常数
以及4 molAr,达平衡时,氮气的转化率为50%,平衡总压为20MPa,计算平衡常数
___________ 。( 计算可用平衡体系物质的分压代替浓度,代入平衡常数表达式,某物质分压=总压×该物质的体积分数)
计算可用平衡体系物质的分压代替浓度,代入平衡常数表达式,某物质分压=总压×该物质的体积分数)
(2)研究1,3-丁二烯和 以物质的量之比为1:1加成时的反应:
以物质的量之比为1:1加成时的反应:
1,2-加成: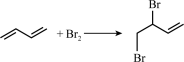 (产物A)
(产物A)
1,4-加成: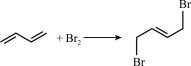 (产物B)
(产物B)
1,3-丁二烯和 以物质的量之比为1:1加成时的反应过程和能量变化如图:
以物质的量之比为1:1加成时的反应过程和能量变化如图:
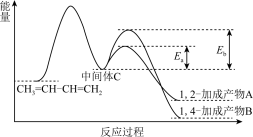
①稳定性:A___________ B(填“>”、“=”或“<”)
②探究1,2-加成和1,4-加成的影响因素。
实验1:将1,3-丁二烯和 以物质的量之比1:1加成,不同温度,相同时间内测定A和B在产物中的含量,低温时产物以A为主,较高温度时以B为主。
以物质的量之比1:1加成,不同温度,相同时间内测定A和B在产物中的含量,低温时产物以A为主,较高温度时以B为主。
实验2:加热实验1中低温时的反应产物,A的含量减少,B的含量增大。
实验3:在实验1的基础上,充分延长反应时间,无论是低温还是高温,产物中B的含量均增大。
结合反应过程和能量变化的示意图,解释实验1中低温时产物以A为主的原因___________ 。
③说明实验2中,升高温度,A转化为B经历的物质转化过程是___________ 。
(1)工业合成氨的反应为:
①根据反应的焓变和熵变,分析在298 K时合成氨反应
②有利于化学平衡向生成氨的方向移动的是
A.升高温度,增大压强 B.升高温度,减小压强
C.降低温度,减小压强 D.降低温度,增大压强
③下图为合成氨生产设备流程示意图,下列说法错误的是

A.为防止原料气中混有的杂质使催化剂“中毒”而丧失催化活性,原料气必须经过净化
B.压缩机加压过程,既要考虑平衡移动的问题,又要考虑加压对设备材料的强度设备的制造要求的问题
C.合成氨反应的温度控制在500℃左右,此温度下反应物的平衡转化率最大
D.冷却过程,及时将
④假设在恒温恒容的密闭容器中,通入2 mol
(2)研究1,3-丁二烯和
1,2-加成:
 (产物A)
(产物A)1,4-加成:
 (产物B)
(产物B)1,3-丁二烯和

①稳定性:A
②探究1,2-加成和1,4-加成的影响因素。
实验1:将1,3-丁二烯和
实验2:加热实验1中低温时的反应产物,A的含量减少,B的含量增大。
实验3:在实验1的基础上,充分延长反应时间,无论是低温还是高温,产物中B的含量均增大。
结合反应过程和能量变化的示意图,解释实验1中低温时产物以A为主的原因
③说明实验2中,升高温度,A转化为B经历的物质转化过程是
21-22高三上·吉林·阶段练习
类题推荐
利用天然气制氢称为“蓝氢”。化学原理如下:
Ⅰ.

Ⅱ.

Ⅲ.

(1)
___________  。
。
(2)一定温度下,向某恒容密闭容器中充入1mol (g)和2mol
(g)和2mol (g),若仅发生反应Ⅱ和Ⅲ,下列说法正确的是
(g),若仅发生反应Ⅱ和Ⅲ,下列说法正确的是___________ (填字母)。
A.充入惰性气体,反应Ⅱ平衡向右移动
B.平衡后升高温度,反应速率增大
C.平衡时 的体积分数可能大于80%
的体积分数可能大于80%
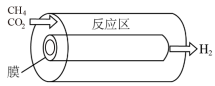
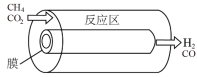
(3)为了探究浓度对平衡的影响,某研究小组设计选择性膜反应器(如图所示)。已知:仅发生反应Ⅰ且在反应区内进行,膜可以对产物进行选择性释放。反应区内通过控制使压强恒定为100kPa.反应开始时,投料均为1mol (g)和1mol
(g)和1mol (g)。膜反应器1中0~80s内
(g)。膜反应器1中0~80s内 的平均渗透速率为
的平均渗透速率为 。膜反应器2中
。膜反应器2中 的平均渗透速率不小于膜反应器1。反应区内的部分实验数据如下表(温度相同且保持不变)。请填写下表中空格:
的平均渗透速率不小于膜反应器1。反应区内的部分实验数据如下表(温度相同且保持不变)。请填写下表中空格:
(4)一定条件下,向VL恒容密闭容器中通入2mol (g)、1mol
(g)、1mol (g)、1mol
(g)、1mol (g)发生上述反应Ⅰ、Ⅱ和Ⅲ,达到平衡时,容器中
(g)发生上述反应Ⅰ、Ⅱ和Ⅲ,达到平衡时,容器中 (g)为amol,
(g)为amol, (g)为bmol,
(g)为bmol, (g)为cmol。此温度下,反应Ⅲ的平衡常数
(g)为cmol。此温度下,反应Ⅲ的平衡常数
___________ (用含a、b的代数式表示, 为用平衡分压代替平衡浓度计算的平衡常数,分压=总压×物质的量分数)。
为用平衡分压代替平衡浓度计算的平衡常数,分压=总压×物质的量分数)。
Ⅰ.
Ⅱ.
Ⅲ.
(1)
(2)一定温度下,向某恒容密闭容器中充入1mol
A.充入惰性气体,反应Ⅱ平衡向右移动
B.平衡后升高温度,反应速率增大
C.平衡时
(3)为了探究浓度对平衡的影响,某研究小组设计选择性膜反应器(如图所示)。已知:仅发生反应Ⅰ且在反应区内进行,膜可以对产物进行选择性释放。反应区内通过控制使压强恒定为100kPa.反应开始时,投料均为1mol
| 反应器示意图 | 无膜反应器 | 膜反应器1 | 膜反应器2 |
 |  | ||
| 物质 | |||
| 80s达平衡后的物质的量/mol | 0.6 | ② | |
| ① | ③ |
(4)一定条件下,向VL恒容密闭容器中通入2mol
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网