填空题 适中0.65 引用1 组卷123
完成下列填空:
(1)+2价的亚铁离子是血红蛋白(用于运输氧气)的重要组成成分。工业上常用Cl2处理含Fe2+的FeCl3溶液,请写出该反应的离子方程式:_______ 。
(2)2020年突如其来的“新冠肺炎”使人们认识到含氯消毒剂的重要性。
①“84”消毒液(有效成分为次氯酸钠)在此次抗疫中发挥了重要作用,其工业制备的化学方程式_______ 。
②已知KMnO4与浓盐酸反应也可以用来制取氯气:2KMnO4+16HCl=2KCl+ 2MnCl2+ 5Cl2↑+ 8H2O。氧化剂是_______ (填化学式);若有15.8g KMnO4参与反应,反应中转移的电子为_______ mol。请用单线桥法表示电子转移的方向和数目:_______ 。
(3)某实验小组用“套管实验”来探究Na2CO3和NaHCO3的性质。
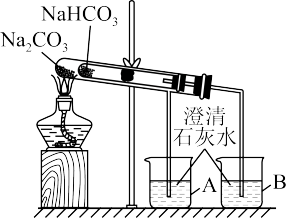
①整个实验过程中,能观察到烧杯B中的现象是_______ 。
②该实验可证明NaHCO3的热稳定性_______ (填“强于”“弱于”或“等于”)Na2CO3;_______ (填“能”或“不能”)将NaHCO3、Na2CO3的位置互换。
(1)+2价的亚铁离子是血红蛋白(用于运输氧气)的重要组成成分。工业上常用Cl2处理含Fe2+的FeCl3溶液,请写出该反应的离子方程式:
(2)2020年突如其来的“新冠肺炎”使人们认识到含氯消毒剂的重要性。
①“84”消毒液(有效成分为次氯酸钠)在此次抗疫中发挥了重要作用,其工业制备的化学方程式
②已知KMnO4与浓盐酸反应也可以用来制取氯气:2KMnO4+16HCl=2KCl+ 2MnCl2+ 5Cl2↑+ 8H2O。氧化剂是
(3)某实验小组用“套管实验”来探究Na2CO3和NaHCO3的性质。

①整个实验过程中,能观察到烧杯B中的现象是
②该实验可证明NaHCO3的热稳定性
21-22高一上·广东湛江·期末
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


