解答题-原理综合题 较难0.4 引用1 组卷145
氮氧化物的排放是造成大气污染的原因之一,消除氮氧化物的污染对生态文明建设具有重要意义,回答下列问题:
(1)①

②

则相同条件下

___________  。
。
(2)一定温度下,将 、
、 充入恒压密闭容器中发生反应
充入恒压密闭容器中发生反应 。已知起始压强为10MPa,10min时反应达到平衡状态,测得
。已知起始压强为10MPa,10min时反应达到平衡状态,测得 的物质的量为0.5mol,则:
的物质的量为0.5mol,则:
①0~10min内,平均反应速率
___________  (保留2位小数)。
(保留2位小数)。
②此反应的平衡常数
___________ ( 是以物质的量分数表示的平衡常数)。
是以物质的量分数表示的平衡常数)。
③该条件下,可判断此反应达到平衡状态的标志是___________ 。
A.单位时间内, 断裂
断裂 同时形成
同时形成
B.混合气体的平均相对分子质量不再改变
C.混合气体的密度不再改变
D.CO与NO的转化率比值不再改变
④若此时再向容器中充入 和
和 ,达到新平衡时NO的转化率将
,达到新平衡时NO的转化率将___________ (填“增大”“减小”或“不变”)。
(3)为探究温度及不同催化剂对反应 的影响,保持其它初始条件不变,分别在不同催化剂(M、N)、不同温度下,测得相同时间内NO转化率与温度的关系如图所示:
的影响,保持其它初始条件不变,分别在不同催化剂(M、N)、不同温度下,测得相同时间内NO转化率与温度的关系如图所示:
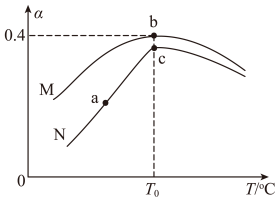
图中c点对应的速率
___________  (填“>”、“<”或“=”),其理由为
(填“>”、“<”或“=”),其理由为___________ 。
(1)①
②
则相同条件下
(2)一定温度下,将
①0~10min内,平均反应速率
②此反应的平衡常数
③该条件下,可判断此反应达到平衡状态的标志是
A.单位时间内,
B.混合气体的平均相对分子质量不再改变
C.混合气体的密度不再改变
D.CO与NO的转化率比值不再改变
④若此时再向容器中充入
(3)为探究温度及不同催化剂对反应

图中c点对应的速率
21-22高二上·山东日照·期末
类题推荐
研究碳氧化物的产生及利用有重要的化学意义。回答下列问题:
(1)反应 的平衡常数约为
的平衡常数约为 ,从热力学角度看,该反应程度应该很大,实际汽车尾气中该反应的程度很小,原因是
,从热力学角度看,该反应程度应该很大,实际汽车尾气中该反应的程度很小,原因是_______ 。
(2)向2L密闭容器中通入2molCO和 ,在适合的催化剂和温度
,在适合的催化剂和温度 下,发生反应:
下,发生反应:
 ,保持容器容积一直不变,10min时,反应达到平衡状态,15min时将温度变为
,保持容器容积一直不变,10min时,反应达到平衡状态,15min时将温度变为 ,20min时反应再次达到平衡状态,部分数据如下表:
,20min时反应再次达到平衡状态,部分数据如下表:
①20min时,反应再次达到平衡状态时的化学平衡常数
_______  ;
;
②恒温恒容时,可以判断反应 达到平衡状态的有
达到平衡状态的有_______ (填标号)。
A. B.容器内混合气体的密度不再改变
B.容器内混合气体的密度不再改变
C.CO和 的转化率的比值保持不变 D.容器内混合气体的平均相对分子质量不变
的转化率的比值保持不变 D.容器内混合气体的平均相对分子质量不变
(3)用 和
和 在一定条件下可转化生成甲醇蒸气和水蒸气:
在一定条件下可转化生成甲醇蒸气和水蒸气:
 。一定条件下,在相同体积的恒容密闭容器中充入
。一定条件下,在相同体积的恒容密闭容器中充入 和
和 ,相同时间段内测得
,相同时间段内测得 的转化率随温度的变化如图所示。
的转化率随温度的变化如图所示。

①d点
_______  (填“>”“<”或“=”);
(填“>”“<”或“=”);
②b点 的转化率比a点的高,原因是
的转化率比a点的高,原因是_______ ,已知容器内的起始压强为160kPa,则图中d点对应温度下反应的平衡常数
_______  (
( 为以分压表示的平衡常数,分压=总压×物质的量分数)。
为以分压表示的平衡常数,分压=总压×物质的量分数)。
(1)反应
(2)向2L密闭容器中通入2molCO和
| 反应时间/min | |||
| 0 | 2 | 4 | 0 |
| 10 | 2 | ||
| 20 | 0.2 |
②恒温恒容时,可以判断反应
A.
C.CO和
(3)用

①d点
②b点
研究NOx、CO、SO2等大气污染气体的治理,对保护环境有重要的意义。回答下列问题:
(1)NOx与CO反应生成无污染气体的相关热化学方程式如下:
①NO2(g)+CO(g) CO2(g)+NO(g) ΔH1=−234.0kJ·mol−1
CO2(g)+NO(g) ΔH1=−234.0kJ·mol−1
②4NO(g) 2NO2(g)+N2(g) ΔH2=−291.8kJ·mol−1
2NO2(g)+N2(g) ΔH2=−291.8kJ·mol−1
反应③2NO2(g)+4CO(g) N2(g)+4CO2(g)的ΔH3=
N2(g)+4CO2(g)的ΔH3=___ kJ·mol−1,有利于提高该反应NO2平衡转化率的条件是___ (填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
(2)在一定温度下,向2L的恒容密闭容器中充入4.0molNO2和4.0molCO,在催化剂作用下发生反应:2NO2(g)+4CO(g) N2(g)+4CO2(g),测得相关数据如下:
N2(g)+4CO2(g),测得相关数据如下:
①其他条件不变,若不使用催化剂,则0~5minNO2的转化率将___ (填“变大”、“变小”或“不变”)。
②以下表述能说明该反应已达到平衡状态的是___ 。
A.CO的反应速率为N2的4倍
B.气体的颜色不再变化
C.化学平衡常数K不再变化
D.混合气的压强不再变化
③该温度下反应的化学平衡常数K=__ (保留两位有效数字)。
④在20min时,保持温度不变,继续向容器中再加入2.0molNO2和2.0molN2,则化学平衡__ 移动(填“正向”、“逆向”或“不”)。
(3)在高效催化剂的作用下用CH4还原NO2,也可消除氮氧化物的污染。
①CH4还原NO2反应的化学方程式为___ 。
②在相同条件下,选用A、B、C三种不同催化剂进行反应,生成N2的物质的量与时间变化如图图1所示,其中活化能最大的是___ [Ea(A)、Ea(B)、Ea(C)分别表示三种催化剂下该反应的活化能]。
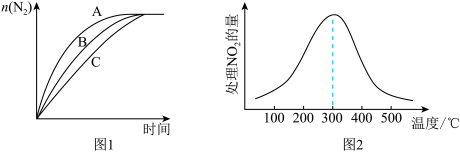
③在催化剂A作用下,测得相同时间内处理NO2的量与温度的关系如图2所示,曲线先增大后减小的可能原因是___ 。
(1)NOx与CO反应生成无污染气体的相关热化学方程式如下:
①NO2(g)+CO(g)
 CO2(g)+NO(g) ΔH1=−234.0kJ·mol−1
CO2(g)+NO(g) ΔH1=−234.0kJ·mol−1②4NO(g)
 2NO2(g)+N2(g) ΔH2=−291.8kJ·mol−1
2NO2(g)+N2(g) ΔH2=−291.8kJ·mol−1反应③2NO2(g)+4CO(g)
 N2(g)+4CO2(g)的ΔH3=
N2(g)+4CO2(g)的ΔH3=A.高温低压 B.低温高压 C.高温高压 D.低温低压
(2)在一定温度下,向2L的恒容密闭容器中充入4.0molNO2和4.0molCO,在催化剂作用下发生反应:2NO2(g)+4CO(g)
 N2(g)+4CO2(g),测得相关数据如下:
N2(g)+4CO2(g),测得相关数据如下:| 0min | 5min | 10min | 15min | 20min | |
| c(NO2)/mol·L−1 | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
| c(N2)/mol·L−1 | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
①其他条件不变,若不使用催化剂,则0~5minNO2的转化率将
②以下表述能说明该反应已达到平衡状态的是
A.CO的反应速率为N2的4倍
B.气体的颜色不再变化
C.化学平衡常数K不再变化
D.混合气的压强不再变化
③该温度下反应的化学平衡常数K=
④在20min时,保持温度不变,继续向容器中再加入2.0molNO2和2.0molN2,则化学平衡
(3)在高效催化剂的作用下用CH4还原NO2,也可消除氮氧化物的污染。
①CH4还原NO2反应的化学方程式为
②在相同条件下,选用A、B、C三种不同催化剂进行反应,生成N2的物质的量与时间变化如图图1所示,其中活化能最大的是

③在催化剂A作用下,测得相同时间内处理NO2的量与温度的关系如图2所示,曲线先增大后减小的可能原因是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网



