解答题-实验探究题 适中0.65 引用3 组卷415
某小组通过实验探究NO的某些性质。
(1)从氮元素的价态角度分析,NO有_____ 性。
(2)以Cu和HNO3为原料制备NO,反应的化学方程式为______ 。
(3)设计实验探究NO的氧化性。
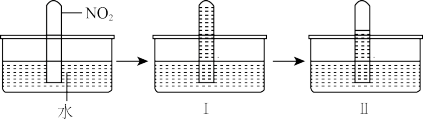
实验Ⅰ:用排水法收集一瓶NO,将其倒扣在盛有碱性Na2SO3溶液的水槽中,振荡,观察到集气瓶中液面上升。
资料:ⅰ.NO与碱性Na2SO3溶液会发生氧化还原反应,NO被还原为N2O 。
。
ⅱ.Ag+与N2O 反应生成黄色沉淀。
反应生成黄色沉淀。
①检验SO 的氧化产物。取少量实验Ⅰ反应后集气瓶中的溶液,
的氧化产物。取少量实验Ⅰ反应后集气瓶中的溶液,_____ (填操作和实验现象)。
②某同学认为,需通过进一步实验验证NO的氧化性,补充以下实验:
实验Ⅱ:取饱和Na2SO4溶液,加入少量冰醋酸,再滴加5滴0.1mol/L的AgNO3溶液,无明显变化。
实验Ⅲ:取少量实验Ⅰ反应后集气瓶中的溶液,加入少量冰醋酸,再滴加5滴0.1mol/L的AgNO3溶液,_____ (填实验现象)。
上述实验证明NO有氧化性。
实验Ⅱ的目的是_____ 。
③写出NO与碱性Na2SO3溶液反应的离子方程式______ 。
④从电极反应角度分析NO与碱性Na2SO3溶液的反应。
还原反应:2NO+2e-=N2O
氧化反应:_____ 。
实验Ⅳ:用排水法收集两瓶NO,将其分别倒扣在饱和Na2SO3溶液和加有NaOH的饱和Na2SO3溶液中,后者集气瓶中液面上升更快。
根据上述实验所得结论:_____ 。
(4)某同学结合所学知识设计处理工业废气中SO2和NO的实验方案,达到消除污染,保护环境的目的。
①先用饱和纯碱溶液吸收废气中的SO2,反应的化学方程式是_____ 。
②再向生成的溶液中加入一定量_____ ,以此溶液来吸收NO气体。
(1)从氮元素的价态角度分析,NO有
(2)以Cu和HNO3为原料制备NO,反应的化学方程式为
(3)设计实验探究NO的氧化性。
实验Ⅰ:用排水法收集一瓶NO,将其倒扣在盛有碱性Na2SO3溶液的水槽中,振荡,观察到集气瓶中液面上升。
资料:ⅰ.NO与碱性Na2SO3溶液会发生氧化还原反应,NO被还原为N2O
ⅱ.Ag+与N2O
①检验SO
②某同学认为,需通过进一步实验验证NO的氧化性,补充以下实验:
实验Ⅱ:取饱和Na2SO4溶液,加入少量冰醋酸,再滴加5滴0.1mol/L的AgNO3溶液,无明显变化。
实验Ⅲ:取少量实验Ⅰ反应后集气瓶中的溶液,加入少量冰醋酸,再滴加5滴0.1mol/L的AgNO3溶液,
上述实验证明NO有氧化性。
实验Ⅱ的目的是
③写出NO与碱性Na2SO3溶液反应的离子方程式
④从电极反应角度分析NO与碱性Na2SO3溶液的反应。
还原反应:2NO+2e-=N2O
氧化反应:
实验Ⅳ:用排水法收集两瓶NO,将其分别倒扣在饱和Na2SO3溶液和加有NaOH的饱和Na2SO3溶液中,后者集气瓶中液面上升更快。
根据上述实验所得结论:
(4)某同学结合所学知识设计处理工业废气中SO2和NO的实验方案,达到消除污染,保护环境的目的。
①先用饱和纯碱溶液吸收废气中的SO2,反应的化学方程式是
②再向生成的溶液中加入一定量
21-22高三上·北京石景山·期末
类题推荐
硫代硫酸钠(Na2S2O3)是重要的化工原料易溶于水,在中性或碱性环境下稳定,在酸性溶液水,分解产生S、SO2。
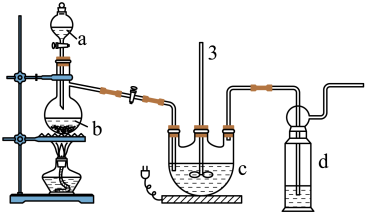
Ⅰ.Na2S2O3的制备。工业上可用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2制得,实验室模拟该工业过程的装置如图所示,其C中试剂为Na2S和Na2SO3的混合液。
(1)b中反应的离子方程式为_____ 。
(2)反应开始后,c中先有浑浊产生,后又变澄清。此浑浊物是_____ 。
(3)为了保证硫代硫酸钠的产量,实验中通入的SO2,不能过量,原因是_____ 。
(4)制备得到的Na2S2O3中可能含有Na2SO3、Na2SO4等杂质。设计实验,检测产品中是否存在Na2SO4:取少量产品_____ 。
Ⅱ.探究Na2S2O3与金属阳离子的氧化还原反应。
资料:ⅰ.Fe3++3S2O
 Fe(S2O3)
Fe(S2O3) (紫黑色)
(紫黑色)
ⅱ.Ag2S2O3为白色沉淀,Ag2S2O3可溶于过量的S2O
(5)根据实验①的现象,初步判断最终Fe3+被S2O 还原为Fe2+,通过
还原为Fe2+,通过_____ (填操作、试剂和现象),进一步证实生成了Fe2+。从化学反应速率和平衡的角度解释实验Ⅰ的现象:_____ 。
(6)同浓度氧化性:Ag+>Fe3+。实验②中Ag+未发生氧化还原反应的原因是_____ 。
(7)进一步探究Ag+和S2O 反应。
反应。
实验③中白色絮状沉淀最后变为黑色沉淀(Ag2S)的化学方程式如下,填入合适的物质和系数:_____ 。
Ag2S2O3+_____=Ag2S+_____
(8)根据以上实验,Na2S2O3与金属阳离子发生氧化还原反应和_____ 有关(写出两条)。

Ⅰ.Na2S2O3的制备。工业上可用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2制得,实验室模拟该工业过程的装置如图所示,其C中试剂为Na2S和Na2SO3的混合液。
(1)b中反应的离子方程式为
(2)反应开始后,c中先有浑浊产生,后又变澄清。此浑浊物是
(3)为了保证硫代硫酸钠的产量,实验中通入的SO2,不能过量,原因是
(4)制备得到的Na2S2O3中可能含有Na2SO3、Na2SO4等杂质。设计实验,检测产品中是否存在Na2SO4:取少量产品
Ⅱ.探究Na2S2O3与金属阳离子的氧化还原反应。
资料:ⅰ.Fe3++3S2O
ⅱ.Ag2S2O3为白色沉淀,Ag2S2O3可溶于过量的S2O
| 装置 | 编号 | 试剂X | 实验现象 |
 | ① | Fe(NO3)3溶液 | 混合后溶液先变成紫黑色,30s后溶液几乎变为无色 |
| ② | AgNO3溶液 | 先生成白色絮状沉淀,振荡后,沉淀溶解,得到无色溶液 |
(5)根据实验①的现象,初步判断最终Fe3+被S2O
(6)同浓度氧化性:Ag+>Fe3+。实验②中Ag+未发生氧化还原反应的原因是
(7)进一步探究Ag+和S2O
| 装置 | 编号 | 试剂X | 实验现象 |
 | ② | AgNO3溶液 | 先生成白色絮状沉淀,沉淀很快变成黄色、棕色,最后为黑色沉淀。 |
Ag2S2O3+_____=Ag2S+_____
(8)根据以上实验,Na2S2O3与金属阳离子发生氧化还原反应和
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网