解答题-原理综合题 适中0.65 引用2 组卷341
氢气是一种重要的工业气体,可用于合成二甲醚( )、氨气等。回答下列问题:
)、氨气等。回答下列问题:
(1)工业上用 和
和 反应合成甲醚:
反应合成甲醚:
 在催化剂存在的恒容密闭容器里,保持
在催化剂存在的恒容密闭容器里,保持 、
、 初始加入量不变,测得在不同温度下,反应相同的时间,容器内
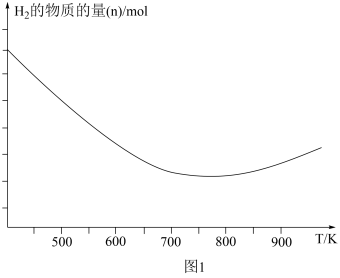
初始加入量不变,测得在不同温度下,反应相同的时间,容器内 的物质的量与温度的关系如图1所示。
的物质的量与温度的关系如图1所示。
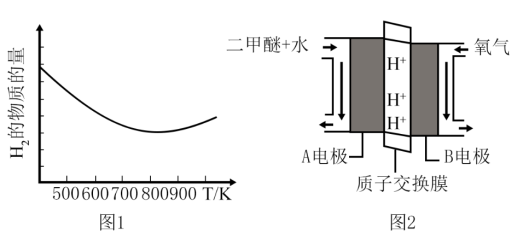
①氢气的物质的量在温度高于800后增大的可能原因是_______ 、_______ 。
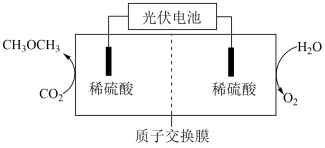
②“直接二甲醚( )燃料电池”被称为绿色电源,其工作原理如图2所示,正极为
)燃料电池”被称为绿色电源,其工作原理如图2所示,正极为_______ 电极(填“A”或“B”),写出A电极的电极反应式:_______ 。
(2)工业上常用氨水吸收二氧化硫,可生成 。判断常温下
。判断常温下 溶液呈
溶液呈_______ 性(填“酸”或“碱”),判断依据是_______ 。(已知: 的
的 ;
; 的
的 ;
; )
)
(3)一定条件下, 与
与 可合成尿素
可合成尿素 :
:
 。某温度下,在容积为1 L的恒容密闭容器中,按不同氨碳比加入总量为3 mol的
。某温度下,在容积为1 L的恒容密闭容器中,按不同氨碳比加入总量为3 mol的 和
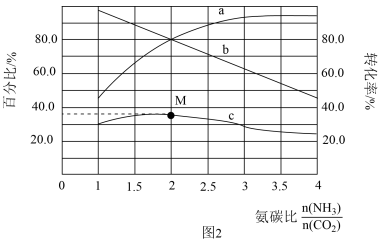
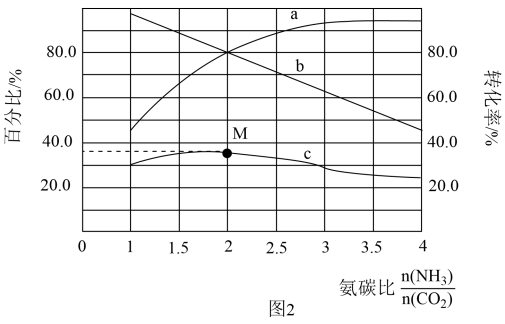
和 混合气体发生反应。反应达到平衡时有关量随氨碳比的变化曲线如图3所示。其中,曲线c表示尿素在平衡体系中的体积百分比。
混合气体发生反应。反应达到平衡时有关量随氨碳比的变化曲线如图3所示。其中,曲线c表示尿素在平衡体系中的体积百分比。
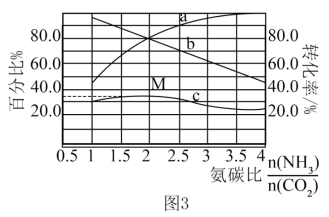
①表示 转化率的曲线是
转化率的曲线是_______ (填“a”或“b”);
②M点对应的百分比为_______ %(保留三位有效数字)。
(1)工业上用

①氢气的物质的量在温度高于800后增大的可能原因是
②“直接二甲醚(
(2)工业上常用氨水吸收二氧化硫,可生成
(3)一定条件下,

①表示
②M点对应的百分比为
21-22高二上·山东济南·期末
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网