解答题-原理综合题 较难0.4 引用3 组卷388
将天然气(主要成分为CH4)中的CO2、H2S资源化转化在能源利用、环境保护等方面意义重大。
(1)CO2转化为CO、H2S转化为S的反应如下:
i.2CO2(g)=2CO(g)+O2(g) △H1=+566kJ/mol
ii.2H2S(g)+O2(g)=2H2O(l)+2S(s) △H2=﹣530kJ/mol
iii.CO2、H2S转化生成CO、S等物质的热化学方程式是___________ 。
(2)CO2性质稳定,是一种“惰性”分子。对于反应ⅲ,通过设计合适的催化剂可以降低______ ,提高反应速率。
a.活化能 b.△H c.平衡常数
(3)我国科学家研制新型催化剂,设计协同转化装置实现反应ⅲ,工作原理如下所示。
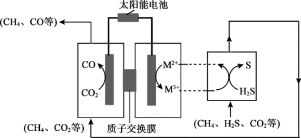
【方案1】若M3+/M2+=Fe3+/Fe2+
①所含Fe3+、Fe2+的溶液需为较强的酸性,原因是___________ 。
②结合反应式说明生成S、CO的原理:___________ 。
【方案2】若M3+/M2+=EDTA-Fe3+/EDTA-Fe2+(配合物)
已知:电解效率η的定义:
③测得η(EDTA-Fe3+)≈100%,η(CO)≈80%。阴极放电的物质有___________ 。
④为进一步确认CO2、H2S能协同转化,对CO的来源分析如下:
来源1:CO2通过电极反应产生CO
来源2:电解质(含碳元素)等物质发生降解,产生CO
设计实验探究,证实来源2不成立。实验方案是___________ 。
结论:方案2明显优于方案1,该研究成果为天然气的净化、资源化转化提供了工业化解决思路。
(1)CO2转化为CO、H2S转化为S的反应如下:
i.2CO2(g)=2CO(g)+O2(g) △H1=+566kJ/mol
ii.2H2S(g)+O2(g)=2H2O(l)+2S(s) △H2=﹣530kJ/mol
iii.CO2、H2S转化生成CO、S等物质的热化学方程式是
(2)CO2性质稳定,是一种“惰性”分子。对于反应ⅲ,通过设计合适的催化剂可以降低
a.活化能 b.△H c.平衡常数
(3)我国科学家研制新型催化剂,设计协同转化装置实现反应ⅲ,工作原理如下所示。

【方案1】若M3+/M2+=Fe3+/Fe2+
①所含Fe3+、Fe2+的溶液需为较强的酸性,原因是
②结合反应式说明生成S、CO的原理:
【方案2】若M3+/M2+=EDTA-Fe3+/EDTA-Fe2+(配合物)
已知:电解效率η的定义:
③测得η(EDTA-Fe3+)≈100%,η(CO)≈80%。阴极放电的物质有
④为进一步确认CO2、H2S能协同转化,对CO的来源分析如下:
来源1:CO2通过电极反应产生CO
来源2:电解质(含碳元素)等物质发生降解,产生CO
设计实验探究,证实来源2不成立。实验方案是
结论:方案2明显优于方案1,该研究成果为天然气的净化、资源化转化提供了工业化解决思路。
21-22高三上·北京朝阳·期末
类题推荐
开发氢能是实现社会可持续发展的需要。下图是以含H2S杂质的天然气为原料制取氢气的流程图。

回答下列问题:
(1)反应②的化学方程式为____________________________________________ 。
(2)反应④的离子方程式为____________________________________________ 。
(3)步骤③中制氢气的原理如下:
Ⅰ:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
Ⅱ:CO(g)+H2O(g) CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
①对于反应Ⅰ,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是________  (填字母代号)。
(填字母代号)。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
②利用反应Ⅱ,将CO进一步转化,可提高H2的产量。若1.00 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO的转化率为____________ 。
③已知:反应Fe(s)+CO2(g) FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g) FeO(s)+H2(g) ΔH2,平衡常数为K2;在不同温度时K1、K2的值如下表:
FeO(s)+H2(g) ΔH2,平衡常数为K2;在不同温度时K1、K2的值如下表:
求:Ⅱ反应的逆反应方程式CO2(g)+H2(g) CO(g)+H2O(g)的平衡常数K=
CO(g)+H2O(g)的平衡常数K=________ (用K1和K2表示),且由表可知,反应CO2(g)+H2(g) CO(g)+H2O(g)是
CO(g)+H2O(g)是___________ 反应(填“吸热”或“放热”)。
(4)我国科研人员也提出了由CO2和CH4转化为高附加值产品和CH3COOH的催化反应历程,该历程示意图如下。下列说法不正确的是________

A.生成CH3COOH总反应的原子利用率为100%
B.CH4→CH3COOH过程中,有C—H键发生断裂
C.①→②放出能量并形成了C—C键
D.该催化剂可有效提高反应物的平衡转化率

回答下列问题:
(1)反应②的化学方程式为
(2)反应④的离子方程式为
(3)步骤③中制氢气的原理如下:
Ⅰ:CH4(g)+H2O(g)
Ⅱ:CO(g)+H2O(g)
①对于反应Ⅰ,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是
 (填字母代号)。
(填字母代号)。a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
②利用反应Ⅱ,将CO进一步转化,可提高H2的产量。若1.00 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO的转化率为
③已知:反应Fe(s)+CO2(g)
| 700 ℃ | 900 ℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
求:Ⅱ反应的逆反应方程式CO2(g)+H2(g)
(4)我国科研人员也提出了由CO2和CH4转化为高附加值产品和CH3COOH的催化反应历程,该历程示意图如下。下列说法不正确的是

A.生成CH3COOH总反应的原子利用率为100%
B.CH4→CH3COOH过程中,有C—H键发生断裂
C.①→②放出能量并形成了C—C键
D.该催化剂可有效提高反应物的平衡转化率
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网