解答题-实验探究题 适中0.65 引用1 组卷70
某小组同学为验证与探究影响化学反应速率的因素,分别设计如下实验方案。
(1)甲同学依据反应:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O,在A、B、C三支试管中按下表物质的量进行实验,记录下的时间数据是:16 s、28 s、33 s。
①将对应a、b、c的时间分别写出:a___________ 、b___________ 、c___________ 。
②实验结论是:___________ 。
(2)乙同学拟验证固体反应物的颗粒大小对反应速率的影响。
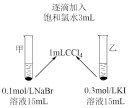
实验步骤:在试管①中加入1 g粉末状大理石,加入2 mol/L盐酸20 mL;在试管②中加入2g颗粒状大理石,加入2 mol/L盐酸40 mL。他根据实验过程,绘制出的生成CO2体积(折算成标准状况)V(CO2)同反应时间t的关系曲线图,你认为下列___________是符合的。
(3)丙同学拟验证还原性:I->Br-,实验操作、现象与结论如下表:
丙同学设计的实验方案___________ (填“合理”或“不合理”),理由是___________ 。
(1)甲同学依据反应:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O,在A、B、C三支试管中按下表物质的量进行实验,记录下的时间数据是:16 s、28 s、33 s。
| 试管编号 | 加3%Na2S2O3 | 加H2O | 加H2SO4(1∶5) | 出现浑浊时间 |
| A | 3 mL | 3 mL | 5滴 | a |
| B | 4 mL | 2 mL | 5滴 | b |
| C | 5 mL | 1 mL | 5滴 | c |
②实验结论是:
(2)乙同学拟验证固体反应物的颗粒大小对反应速率的影响。
实验步骤:在试管①中加入1 g粉末状大理石,加入2 mol/L盐酸20 mL;在试管②中加入2g颗粒状大理石,加入2 mol/L盐酸40 mL。他根据实验过程,绘制出的生成CO2体积(折算成标准状况)V(CO2)同反应时间t的关系曲线图,你认为下列___________是符合的。
A.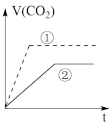 | B.C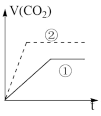 |
C.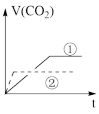 | D.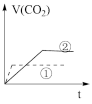 |
| 实验操作 | 实验现象 | 实验结论 |
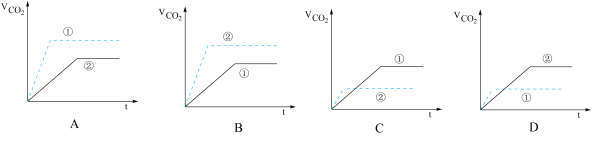
 | 逐滴加入氯水的同时振荡,观察CCl4层的颜色变化,乙中CCl4层颜色明显变化快。 | 结论:验证成立,还原性I- >Br-。 |
21-22高二上·福建漳州·期中
类题推荐
某学习小组同学根据影响化学反应速率的因素进行实验验证,其设计的实验方案如下:请你帮他们把表填写完整,并做出评价。
(1)甲同学验证还原性:I->Br-
【评价】甲同学设计的实验方案是__ (填“合理”或“不合理”),理由是__ 。
(3)乙同学验证固体反应物的颗粒大小的对反应速率影响
实验步骤:在试管①中加入1g粉末状大理石,加入4mol/L盐酸20mL(过量);在试管②中加入2g颗粒状大理石,加入4mol/L盐酸20mL(过量)。他根据实验过程,绘制出的生成CO2生成体积(折算成标准状况)V(CO2)同反应时间t的关系曲线图,你认为__ 是符合的。
(1)甲同学验证还原性:I->Br-
| 实验步骤 | 实验现象 | 实验结论及离子反应式 |
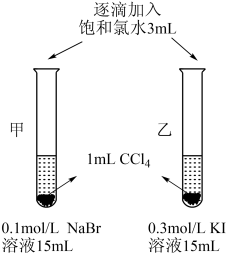 | 逐滴加入的同时振荡,观察CCl4层的颜色: 甲 乙 乙中CCl4层颜色明显变化的快。 | 离子方程式: 甲 乙 结论:验证成立,还原性,I->Br- |
(3)乙同学验证固体反应物的颗粒大小的对反应速率影响
实验步骤:在试管①中加入1g粉末状大理石,加入4mol/L盐酸20mL(过量);在试管②中加入2g颗粒状大理石,加入4mol/L盐酸20mL(过量)。他根据实验过程,绘制出的生成CO2生成体积(折算成标准状况)V(CO2)同反应时间t的关系曲线图,你认为

某研究性学习小组在做Cu 和浓HNO3、稀HNO3反应时,发现生成溶液的颜色有差别。Cu和浓HNO3反应后的溶液为鲜艳草绿色,而Cu和稀HNO3反应溶液为蓝色。
(1)写出Cu和浓HNO3反应的化学方程式:______ 。
(2)该研究性小组成员对反应后生成的溶液颜色差别进行了实验探究。
甲同学认为:绿色是硝酸铜溶液浓度较大引起的,即Cu(NO3)2浓溶液显绿色,Cu(NO3)2稀溶液显蓝色。
乙同学认为:绿色是NO2溶于Cu2+溶液引起的。
①甲同学用Cu(NO3)2晶体配制成稀溶液,溶液为浅蓝色,随着Cu(NO3)2固体的加入,最终配成饱和溶液,颜色逐渐变深,但始终是蓝色。该现象可证明甲同学推测______ (填“合理”或“不合理”)。
②乙同学将Cu与浓HNO3反应后的绿色溶液稍微加热,放出大量红棕色气体,溶液变为______ 色,证明乙同学推测可能成立。
③乙同学设计实验进一步探究,向不同浓度的铜盐溶液中通入NO2气体,实验数据和实验现象如下表:
不同浓度铜盐溶液中通入NO2气体的现象
对比实验1和2,或对比实验3和4,可以得到结论______ 。对比铜与浓硝酸的反应,生成的部分NO2 也会溶入溶液,使溶液呈现绿色。说明“反应混合液”呈绿色确实与NO2气体溶解有关。
(3)丙同学查阅文献:浓硝酸和铜的反应因为有亚硝酸(HNO2)生成,进而可以和Cu2+ 结合成亚硝酸化合物,而铜的亚硝酸化合物是绿色的。
①丙同学设计实验验证生成了亚硝酸(HNO2),取一支试管加入浓硝酸1 mL,插入铜丝后,快速反应,有红棕色气体放出,溶液为绿色;然后加入3滴30%的H2O2溶液,振荡后溶液变为蓝色。分析原因是H2O2和反应过程中生成的HNO2发生了氧化还原反应,写出H2O2和HNO2反应的化学方程式:______ 。
②丙同学继续设计实验验证。取1 mol/LCu(NO3)2溶液2 mL,加入1 mol/L的NaNO2溶液3滴,观察溶液变为绿色,再加入3滴30%H2O2和1滴浓硝酸。溶液很快由绿色变为蓝色。由此可以得到Cu和浓HNO3反应后的溶液为绿色的原因是:______ 。
(1)写出Cu和浓HNO3反应的化学方程式:
(2)该研究性小组成员对反应后生成的溶液颜色差别进行了实验探究。
甲同学认为:绿色是硝酸铜溶液浓度较大引起的,即Cu(NO3)2浓溶液显绿色,Cu(NO3)2稀溶液显蓝色。
乙同学认为:绿色是NO2溶于Cu2+溶液引起的。
①甲同学用Cu(NO3)2晶体配制成稀溶液,溶液为浅蓝色,随着Cu(NO3)2固体的加入,最终配成饱和溶液,颜色逐渐变深,但始终是蓝色。该现象可证明甲同学推测
②乙同学将Cu与浓HNO3反应后的绿色溶液稍微加热,放出大量红棕色气体,溶液变为
③乙同学设计实验进一步探究,向不同浓度的铜盐溶液中通入NO2气体,实验数据和实验现象如下表:
不同浓度铜盐溶液中通入NO2气体的现象
| 实验编号 | ① | ② | ③ | ④ |
| 饱和Cu(NO3)2溶液体积/mL | 2 | 1 | 0 | 0 |
| 蒸馏水体积/mL | 0 | 1 | 0 | 1 |
| 饱和CuSO4溶液体积/mL | 0 | 0 | 2 | 1 |
| 现象 | 蓝绿色 | 蓝绿色 | 绿色 | 绿色 |
(3)丙同学查阅文献:浓硝酸和铜的反应因为有亚硝酸(HNO2)生成,进而可以和Cu2+ 结合成亚硝酸化合物,而铜的亚硝酸化合物是绿色的。
①丙同学设计实验验证生成了亚硝酸(HNO2),取一支试管加入浓硝酸1 mL,插入铜丝后,快速反应,有红棕色气体放出,溶液为绿色;然后加入3滴30%的H2O2溶液,振荡后溶液变为蓝色。分析原因是H2O2和反应过程中生成的HNO2发生了氧化还原反应,写出H2O2和HNO2反应的化学方程式:
②丙同学继续设计实验验证。取1 mol/LCu(NO3)2溶液2 mL,加入1 mol/L的NaNO2溶液3滴,观察溶液变为绿色,再加入3滴30%H2O2和1滴浓硝酸。溶液很快由绿色变为蓝色。由此可以得到Cu和浓HNO3反应后的溶液为绿色的原因是:
影响化学反应速率的因素有很多方面。请回答下列问题:
(一)某学习小组同学根据影响化学反应速率的因素进行实验验证,其设计的实验方案如下:请你帮他们把表填写完整,并做出评价。
(1)甲同学验证还原性:I->Br-
(评价)甲同学设计的实验方案是____ (填“合理”或“不合理”),理由是____ 。
(2)乙同学验证固体反应物的颗粒大小对反应速率影响
实验步骤:在试管①中加入1g粉末状大理石,加入4mol/L盐酸20mL(过量);在试管②中加入2g颗粒状大理石,加入4mol/L盐酸20mL(过量)。他根据实验过程,绘制出的生成CO2生成体积(折算成标准状况)V(CO2)同反应时间t的关系曲线图,你认为____ 是符合的。
(二)控制变量法是化学探究的重要方法,明明同学利用1.0mol·L-1稀硫酸与铁反应,探究响化学反应速率的因素时得到如表实验数据:
分析上述数据,回答下列问题:
(3)实验1和2表明,影响反应速率因素是____ 。表中x=____ ,判断依据为____ 。
(4)表明反应物浓度对化学反应速率影响的实验组是____ (填实验序号)。
(5)本实验中影响反应速率的因素还有____ 。
(6)实验3中若在铁片上放一只碳棒,金属消失的时间会远小于125s,其原因是____ 。
(一)某学习小组同学根据影响化学反应速率的因素进行实验验证,其设计的实验方案如下:请你帮他们把表填写完整,并做出评价。
(1)甲同学验证还原性:I->Br-
| 实验步骤 | 实验现象 | 实验结论及离子反应式 |
 | 逐滴加入的同时振荡,观察CCl4层的颜色: 甲 乙 乙中CCl4层颜色明显变化的快。 | 离子方程式: 甲 乙 结论:验证成立,还原性,I->Br- |
(2)乙同学验证固体反应物的颗粒大小对反应速率影响
实验步骤:在试管①中加入1g粉末状大理石,加入4mol/L盐酸20mL(过量);在试管②中加入2g颗粒状大理石,加入4mol/L盐酸20mL(过量)。他根据实验过程,绘制出的生成CO2生成体积(折算成标准状况)V(CO2)同反应时间t的关系曲线图,你认为
A. | B.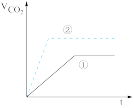 |
C. | D. |
(二)控制变量法是化学探究的重要方法,明明同学利用1.0mol·L-1稀硫酸与铁反应,探究响化学反应速率的因素时得到如表实验数据:
| 实验序号 | 铁的质量/g | 铁的形状 | V(H2SO4)/mL | V(H2O)/mL | 初始溶液的温度/℃ | 金属消失的时间/s |
| 1 | 0.10 | 铁片 | 40 | 10 | 20 | 200 |
| 2 | 0.10 | 铁粉 | 40 | x | 20 | 25 |
| 3 | 0.10 | 铁片 | 50 | 0 | 20 | 125 |
| 4 | 0.10 | 铁片 | 50 | 0 | 35 | 50 |
(3)实验1和2表明,影响反应速率因素是
(4)表明反应物浓度对化学反应速率影响的实验组是
(5)本实验中影响反应速率的因素还有
(6)实验3中若在铁片上放一只碳棒,金属消失的时间会远小于125s,其原因是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


