解答题-原理综合题 适中0.65 引用1 组卷111
研究和深度开发CO2的综合应用,实现碳循环是解决温室问题的有效途径,对构建生态文明社会具有重要意义。二氧化碳加氢制甲醇的总反应可表示为:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH=-49.6kJ/mol。
(1)该反应一般认为通过如下步骤来实现:
i.CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH1=+41.2kJ/mol
ii.CO(g)+2H2(g)⇌CH3OH(g) ΔH2
则△H2=___________ kJ/mol。
(2)下列措施中,能提高CO2转化率的是___________。
(3)一定条件下,往2L恒容密闭容器中充入1molCO2和3molH2,在催化剂作用下发生反应,测得5min时CO2的转化率在五种不同温度下的变化如图所示。

①T4温度下,反应在0~5min内平均反应速率v(H2)=___________ mol/(L·min)。
②b点对应的正反应速率v(正)___________ c点对应逆反应速率v(逆)(填“>”“<”或“=”)。
③若反应在c点的体系总压强为0.80MPa,则c点反应的Kp=____ (MPa)-2(Kp为以分压表示的平衡常数)。
(4)TiO2基催化剂光催化还原CO2亦可制得燃料甲醇,其原理如图所示。
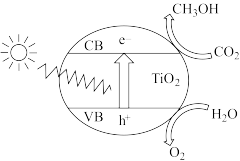
①CB极的电势___________ VB极的电势(填“低于”或“高于”)。
②CB极的反应式是___________ 。
(1)该反应一般认为通过如下步骤来实现:
i.CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH1=+41.2kJ/mol
ii.CO(g)+2H2(g)⇌CH3OH(g) ΔH2
则△H2=
(2)下列措施中,能提高CO2转化率的是___________。
| A.在原料气中加入适量H2O(g) | B.从体系中不断分离出甲醇 |
| C.循环利用原料气 | D.提高原料气中CO2的体积分数 |

①T4温度下,反应在0~5min内平均反应速率v(H2)=
②b点对应的正反应速率v(正)
③若反应在c点的体系总压强为0.80MPa,则c点反应的Kp=
(4)TiO2基催化剂光催化还原CO2亦可制得燃料甲醇,其原理如图所示。

①CB极的电势
②CB极的反应式是
21-22高三上·湖北·期末
类题推荐
Ⅰ.甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g) CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2=−58kJ⋅mol-1
CH3OH(g)+H2O(g) △H2=−58kJ⋅mol-1
③CO2(g)+H2(g) CO(g)+H2O(g) △H3=+41 kJ⋅mol-1
CO(g)+H2O(g) △H3=+41 kJ⋅mol-1
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
则△H1=______ kJ⋅mol-1。X=___________ 。
Ⅱ.丙烯是重要的有机化工原料,丙烷脱氢制丙烯具有显著的经济价值和社会意义。反应原理如下:C3H8(g) C3H6(g)+H2(g) △H
C3H6(g)+H2(g) △H
(2)一定温度下,向 10L恒容密闭容器中充入 2molC3H8发生反应,经过 10min达到平衡状态,测得平衡时气体压强是开始的 1.75 倍。
①0~10min内丙烯的生成速率v(C3H6)=___ ,C3H8的平衡转化率为___ 。
②下列情况能说明该反应达到平衡状态的是___ 。
A.气体密度保持不变
B. 保持不变
保持不变
C.△H1 保持不变
D.C3H8分解速率与 C3H6消耗速率相等
(3)总压强分别为 p1和 p2时,上述反应在不同温度下达到平衡,测得丙烷及丙烯的物质的量分数如图所示:

①压强:p1___ (填“>”或“<”)p2。
②为了提高反应速率和反应物的转化率,可采取的措施是________________ 。
③若p1=0.1MPa,起始时充入一定量的丙烷发生反应,计算Q点对应温度下该反应的平衡常数Kp=________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
①CO(g)+2H2(g)
②CO2(g)+3H2(g)
③CO2(g)+H2(g)
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
| 化学键 | H−H | C−O | H−O | C−H | |
| E/( kJ⋅mol-1) | 436 | 343 | 1076 | 465 | X |
则△H1=
Ⅱ.丙烯是重要的有机化工原料,丙烷脱氢制丙烯具有显著的经济价值和社会意义。反应原理如下:C3H8(g)
(2)一定温度下,向 10L恒容密闭容器中充入 2molC3H8发生反应,经过 10min达到平衡状态,测得平衡时气体压强是开始的 1.75 倍。
①0~10min内丙烯的生成速率v(C3H6)=
②下列情况能说明该反应达到平衡状态的是
A.气体密度保持不变
B.
C.△H1 保持不变
D.C3H8分解速率与 C3H6消耗速率相等
(3)总压强分别为 p1和 p2时,上述反应在不同温度下达到平衡,测得丙烷及丙烯的物质的量分数如图所示:

①压强:p1
②为了提高反应速率和反应物的转化率,可采取的措施是
③若p1=0.1MPa,起始时充入一定量的丙烷发生反应,计算Q点对应温度下该反应的平衡常数Kp=
温室气体的利用是当前环境和能源领域的研究热点,合理利用燃料废气中的 ,也是实现“碳中和”的途径之一
,也是实现“碳中和”的途径之一
Ⅰ.温室气体 转化为重要的工业原料甲酸是目前科学研究的热点。回答下列问题:
转化为重要的工业原料甲酸是目前科学研究的热点。回答下列问题:
(1)已知:①
②2CO(g)+O2(g) 2CO2(g) ΔH2=-566.0kJ/mol
2CO2(g) ΔH2=-566.0kJ/mol
则反应③
_______ 
(2)刚性绝热密闭容器中,等物质的量的 和
和 发生反应③,下列可判断反应达到平衡的是_______(填标号)。
发生反应③,下列可判断反应达到平衡的是_______(填标号)。
(3)在催化剂作用下 和
和 也可以合成甲酸,主要涉及以下反应:
也可以合成甲酸,主要涉及以下反应:
ⅰ.CO2(g)+H2(g) HCOOH(g) ΔH1<0
HCOOH(g) ΔH1<0
ⅱ. CO2(g)+H2(g) CO (g)+H2O(g) ΔH2>0
CO (g)+H2O(g) ΔH2>0
刚性密闭容器中CO2(g)和H2(g)按物质的量1:1投料,平衡时HCOOH和CO的选择性随温度变化如图1所示。
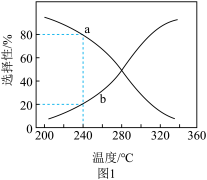
①曲线a随温度升高而下降的原因是_______ ;
②为同时提高CO2的平衡转化率和平衡时HCOOH的选择性,应选择的反应条件为_______ (填标号)。
A.低温、低压 B.高温、高压 C.高温、低压 D.低温、高压
③240℃时,容器内压强随时间的变化如表所示:
反应ⅰ的速率可表示为v=k·p(CO2) ·p(H2)(k为常数),则反应在60min时v=_______ (用含p0、k的式子表示)。
Ⅱ. CO2-CH4催化重整对减少温室气体的排放、改善大气环境具有重要的意义。催化重整反应为:。
(4)在密闭容器中通入物质的量均为0.2mol的CH4和CO2,在一定条件下发生反应 ,CH4的平衡转化率与温度及压强的关系如图2所示。
,CH4的平衡转化率与温度及压强的关系如图2所示。
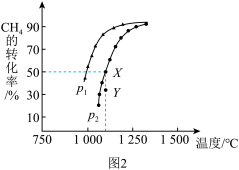
①由图可知:p1压强_______ p2 (填“>”、“<”或“=”)。
②Y点:v(正)_______ v(逆)(填“>”、“<”或“=”);已知气体分压(p分)=气体总压(p总) 气体的物质的量分数。用平衡分压代替平衡浓度可以得到平衡常数Kp,已知p2=akPa,求X点对应温度下反应的平衡常数Kp=
气体的物质的量分数。用平衡分压代替平衡浓度可以得到平衡常数Kp,已知p2=akPa,求X点对应温度下反应的平衡常数Kp=_______ 。
Ⅰ.温室气体
(1)已知:①
②2CO(g)+O2(g)
则反应③
(2)刚性绝热密闭容器中,等物质的量的
| A. |
| B.容器内压强不变 |
| C. |
| D.容器中气体密度不变 |
ⅰ.CO2(g)+H2(g)
ⅱ. CO2(g)+H2(g)
刚性密闭容器中CO2(g)和H2(g)按物质的量1:1投料,平衡时HCOOH和CO的选择性随温度变化如图1所示。

①曲线a随温度升高而下降的原因是
②为同时提高CO2的平衡转化率和平衡时HCOOH的选择性,应选择的反应条件为
A.低温、低压 B.高温、高压 C.高温、低压 D.低温、高压
③240℃时,容器内压强随时间的变化如表所示:
| 时间/min | 0 | 20 | 40 | 60 | 80 |
| 压强/MPa | p0 | 0.91 p0 | 0.85 p0 | 0.80 p0 | 0.80 p0 |
Ⅱ. CO2-CH4催化重整对减少温室气体的排放、改善大气环境具有重要的意义。催化重整反应为:。
(4)在密闭容器中通入物质的量均为0.2mol的CH4和CO2,在一定条件下发生反应

①由图可知:p1压强
②Y点:v(正)
随着我国碳达峰、碳中和目标的确定,二氧化碳资源化利用倍受关注。
I.以CO2和NH3为原料合成尿素2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g) ∆H
CO(NH2)2(s)+H2O(g) ∆H
(1)有利于提高CO2平衡转化率的措施是_______(填序号)。
(2)研究发现,合成尿素反应分两步完成,其能量变化如下图甲所示:
第一步: 2NH3(g)+CO2(g) NH2COONH4(s) ∆H1
NH2COONH4(s) ∆H1
第二步:NH2COONH4(s) CO(NH2)2(s)+H2O(g) ∆H2
CO(NH2)2(s)+H2O(g) ∆H2
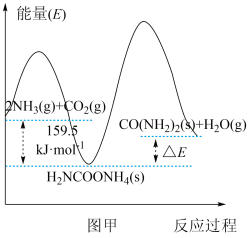
①已知图中ΔE=72 kJ/mol,则∆H=____________________ 。
②决定总反应速率的是_______ 反应(填“第一步”或“第二步”),理由是___ 。
Ⅱ.以CO2和CH4催化重整制备合成气:CO2(g)+CH4(g) 2CO(g)+ 2H2(g)。
2CO(g)+ 2H2(g)。
(3)在密闭容器中通入物质的量均为0.2 mol的CH4和CO2,在一定条件下发生反应CH4(g) +CO2(g) 2CO(g)+2H2(g),CH4的平衡转化率随温度、压强的变化关系如图乙所示。
2CO(g)+2H2(g),CH4的平衡转化率随温度、压强的变化关系如图乙所示。
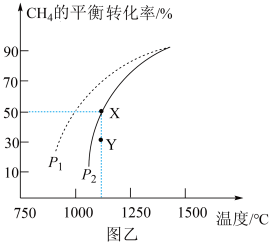
①若反应在恒温、恒容密闭容器中进行,下列叙述能说明反应到达平衡状态的是_______ (填序号)。
A.容器中混合气体的密度保持不变 B. 容器内混合气体的压强保持不变
C.反应速率: 2v正(CO2)=v正(H2) D.同时断裂2molC-H键和1 molH-H键
②由图乙可知,压强P1_______ P2 (填“>”“<”或“=”,下同); Y点速率v正_______ v逆。
③已知气体分压=气体总压x气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数Kp,则X点对应温度下的Kp=_______ (用含P2的代数式表示)。
I.以CO2和NH3为原料合成尿素2NH3(g)+CO2(g)
(1)有利于提高CO2平衡转化率的措施是_______(填序号)。
| A.高温低压 | B.低温高压 | C.高温高压 | D.低温低压 |
第一步: 2NH3(g)+CO2(g)
第二步:NH2COONH4(s)

①已知图中ΔE=72 kJ/mol,则∆H=
②决定总反应速率的是
Ⅱ.以CO2和CH4催化重整制备合成气:CO2(g)+CH4(g)
(3)在密闭容器中通入物质的量均为0.2 mol的CH4和CO2,在一定条件下发生反应CH4(g) +CO2(g)

①若反应在恒温、恒容密闭容器中进行,下列叙述能说明反应到达平衡状态的是
A.容器中混合气体的密度保持不变 B. 容器内混合气体的压强保持不变
C.反应速率: 2v正(CO2)=v正(H2) D.同时断裂2molC-H键和1 molH-H键
②由图乙可知,压强P1
③已知气体分压=气体总压x气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数Kp,则X点对应温度下的Kp=
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


