解答题-原理综合题 适中0.65 引用2 组卷536
将 和
和 两种引发温室效应气体转化为合成气(
两种引发温室效应气体转化为合成气( 和
和 ),可以实现能量综合利用,对环境保护具有十分重要的意义。
),可以实现能量综合利用,对环境保护具有十分重要的意义。
(1)甲烷二氧化碳干式重整涉及以下反应
a.
 平衡常数为
平衡常数为
b.
 平衡常数为
平衡常数为
c.
 平衡常数为
平衡常数为
① 为标准摩尔生成焓,其定义为标准状态下,由稳定相态的单质生成1mol该物质的焓变。对于稳定相态单质,其
为标准摩尔生成焓,其定义为标准状态下,由稳定相态的单质生成1mol该物质的焓变。对于稳定相态单质,其 为零。根据下表所示数据,计算反应a的反应热
为零。根据下表所示数据,计算反应a的反应热
_______ ,该反应在_______ (填“高温”或“低温”)下能自发进行。
②以上三个反应的平衡常数K与温度T存在函数关系: ,
, ,
, ,其中m、n、p为常数,则
,其中m、n、p为常数,则 的数值范围是
的数值范围是_______ (填序号)。
A. B.
B. C.
C. D.
D.
(2)甲烷的水蒸气重整涉及以下反应
Ⅰ.
Ⅱ.
在一密闭容器中,通入1mol 和3mol
和3mol 发生甲烷的水蒸气重整反应。
发生甲烷的水蒸气重整反应。
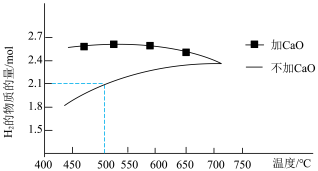
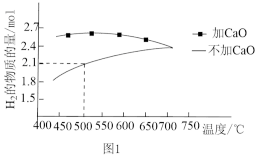
①压强为 kPa时,分别在加
kPa时,分别在加 和不加
和不加 时,平衡体系中
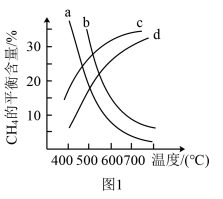
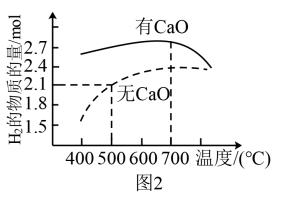
时,平衡体系中 的物质的量随温度变化如图1所示。温度低于700℃时,加入
的物质的量随温度变化如图1所示。温度低于700℃时,加入 可明显提高混合气中
可明显提高混合气中 的量,原因是
的量,原因是_______ 。
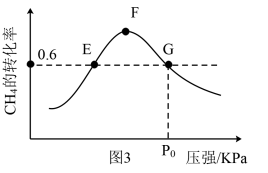
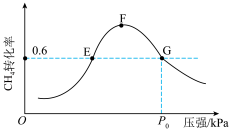
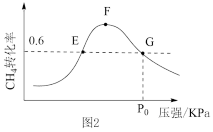
②500℃时,反应相同时间后测得 的转化率(α)随压强的变化如图2所示。则图2中E点和G点
的转化率(α)随压强的变化如图2所示。则图2中E点和G点 的浓度大小关系为
的浓度大小关系为
_______  (填“>”“<”或“=”),此温度下反应Ⅱ的分压平衡常数
(填“>”“<”或“=”),此温度下反应Ⅱ的分压平衡常数 (用分压代替浓度,分压等于总压×物质的量分数)为
(用分压代替浓度,分压等于总压×物质的量分数)为_______ 。
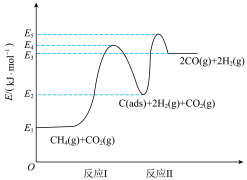
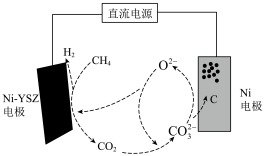
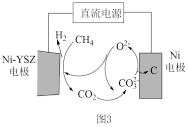
③甲烷蒸汽重整工业制氢面临着大量的“碳排放”,我国科技工作者发明了一种电化学分解甲烷的方法,其电化学反应原理如图3所示。请写出Ni-YSZ电极上发生的电极反应方程式:_______ 。
(1)甲烷二氧化碳干式重整涉及以下反应
a.
b.
c.
①
| 物质 | |||
| -74.8 | -393.5 | -110.5 |
A.
(2)甲烷的水蒸气重整涉及以下反应
Ⅰ.
Ⅱ.
在一密闭容器中,通入1mol
①压强为

②500℃时,反应相同时间后测得

③甲烷蒸汽重整工业制氢面临着大量的“碳排放”,我国科技工作者发明了一种电化学分解甲烷的方法,其电化学反应原理如图3所示。请写出Ni-YSZ电极上发生的电极反应方程式:

21-22高三上·全国·阶段练习
类题推荐  的回收与利用是科学家研究的热点课题,可利用
的回收与利用是科学家研究的热点课题,可利用 与
与 制备“合成气(CO、
制备“合成气(CO、 ),还可制备甲醇、二甲醚、碳基燃料等产品。
),还可制备甲醇、二甲醚、碳基燃料等产品。
(1)甲烷二氧化碳干式重整涉及以下反应:
i.


ii.


iii.


① 为标准摩尔生成焓,其定义为标准状态下,由稳定相态的单质生成1mol该物质的焓变。对于稳定相态单质,
为标准摩尔生成焓,其定义为标准状态下,由稳定相态的单质生成1mol该物质的焓变。对于稳定相态单质, 其为零。根据下表所示数据,计算反应
其为零。根据下表所示数据,计算反应 的反应热
的反应热
_______
②在体积为 的恒温恒容密闭容器中,通入
的恒温恒容密闭容器中,通入 、
、 和
和 发生甲烷二氧化碳干式重整反应,达到平衡时,
发生甲烷二氧化碳干式重整反应,达到平衡时, ,
, ,反应ⅲ的平衡常数
,反应ⅲ的平衡常数
_______ (用含有a和b的代数式表示)。
(2)“合成气”在催化剂作用下反应,可以直接合成甲醇:
 ,测得相同时间内甲醇产率与温度的关系如图1所示。
,测得相同时间内甲醇产率与温度的关系如图1所示。
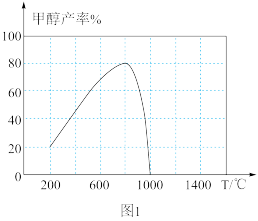
温度在800℃以上甲醇产率下降的原因是_______ 。
(3)利用“合成气”合成甲醇后,甲醇脱水制得二甲醚的反应为: ,当
,当 时,反应平衡常数
时,反应平衡常数 ,在密闭答器中加入一定量
,在密闭答器中加入一定量 ,反应到达平衡状态时,体系中
,反应到达平衡状态时,体系中 的物质的量分数
的物质的量分数_______ (填标号)。
a. b.
b. c.
c. d.无法确定
d.无法确定
(4)我国科技工作者发明了一种电化学分解甲烷制备 的方法,其电化学反应原理如图2所示。请写出Ni-YSZ电极上发生的电极反应方程式:
的方法,其电化学反应原理如图2所示。请写出Ni-YSZ电极上发生的电极反应方程式:_______ ,标况下每分解 ,Ni电极产生的
,Ni电极产生的 的物质的量是
的物质的量是_______ 。

(1)甲烷二氧化碳干式重整涉及以下反应:
i.
ii.
iii.
①
| 物质 | CO | ||
(2)“合成气”在催化剂作用下反应,可以直接合成甲醇:

温度在800℃以上甲醇产率下降的原因是
(3)利用“合成气”合成甲醇后,甲醇脱水制得二甲醚的反应为:
a.
(4)我国科技工作者发明了一种电化学分解甲烷制备

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网