单选题 适中0.65 引用10 组卷6221
N2是合成氨工业的重要原料,NH3不仅可制造化肥,还能通过催化氧化生产HNO3;HNO3能溶解Cu、Ag等金属,也能与许多有机化合物发生反应;在高温或放电条件下,N2与O2反应生成NO,NO进一步氧化生成NO2。2NO(g)+O2(g)=2NO2(g) ΔH=-116.4kJ·mol-1。大气中过量的NOx和水体中过量的NH 、NO
、NO 均是污染物。通过催化还原的方法,可将烟气和机动车尾气中的NO转化为N2,也可将水体中的NO3-转化为N2。对于反应2NO(g)+O2(g)
均是污染物。通过催化还原的方法,可将烟气和机动车尾气中的NO转化为N2,也可将水体中的NO3-转化为N2。对于反应2NO(g)+O2(g) 2NO2(g),下列说法正确的是
2NO2(g),下列说法正确的是
| A.该反应的ΔH<0,ΔS<0 |
| B.反应的平衡常数可表示为K= |
| C.使用高效催化剂能降低反应的焓变 |
| D.其他条件相同,增大 |
2021·江苏·高考真题
类题推荐
如NOx是大气中主要的污染物。大气中过量的NOx和水体中过量的NH 、NO
、NO 、NO
、NO 均是污染物。通过催化还原的方法,可将烟气和机动车尾气中的NO转化为N2[反应为
均是污染物。通过催化还原的方法,可将烟气和机动车尾气中的NO转化为N2[反应为 △H=-746.5kJ·mol-1];也可将水体中的NO
△H=-746.5kJ·mol-1];也可将水体中的NO 、NO
、NO 转化为N2。对于反应
转化为N2。对于反应 ,下列说法正确的是
,下列说法正确的是
| A.该反应在任何条件下都能自发进行 |
| B.反应的平衡常数可表示为K= |
| C.使用高效的催化剂可以降低反应的焓变 |
| D.其它条件不变,增大 |
阅读下列资料,完成有关小题。
N2是合成氨工业的重要原料,工业合成氨反应为N2(g)+3H2(g)⇌2NH3(g) ΔH=-92.4kJ·mol-1。NH3不仅可制造化肥,还能通过催化氧化生产HNO3;HNO3能溶解Cu、Ag等金属,也能与许多有机化合物发生反应;在高温或放电条件下,N2与O2反应生成NO,NO进一步氧化生成NO2。2NO(g)+O2(g)⇌2NO2(g) ΔH=-116.4kJ·mol-1。大气中过量的NOx和水体中过量的 、
、 均是污染物。通过催化还原的方法,可将烟气和汽车尾气中的NO转化为N2,也可将水体中的
均是污染物。通过催化还原的方法,可将烟气和汽车尾气中的NO转化为N2,也可将水体中的 转化为N2。
转化为N2。
【小题1】下列说法正确的是
【小题2】犹他大学化学家发明了N2/H2生物燃料电池,以质子交换膜为隔膜,室温条件下合成了氨(工作原理如图所示)。有关该电池的说法正确的是
【小题3】对于反应2NO(g)+O2(g)⇌2NO2(g) ΔH=-116.4kJ·mol-1。下列说法正确的是
【小题4】关于0.1mol·L-1氨水,下列说法正确的是
N2是合成氨工业的重要原料,工业合成氨反应为N2(g)+3H2(g)⇌2NH3(g) ΔH=-92.4kJ·mol-1。NH3不仅可制造化肥,还能通过催化氧化生产HNO3;HNO3能溶解Cu、Ag等金属,也能与许多有机化合物发生反应;在高温或放电条件下,N2与O2反应生成NO,NO进一步氧化生成NO2。2NO(g)+O2(g)⇌2NO2(g) ΔH=-116.4kJ·mol-1。大气中过量的NOx和水体中过量的
【小题1】下列说法正确的是
| A.关于合成氨反应,升高温度,v逆增大,v正减小,故平衡逆向移动 |
| B.沸点:NH3<PH3 |
| C.NH4NO3和N2的晶体类型相同 |
| D.NH3的键角比 |
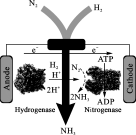
| A.“Anode”意为阴极、“Cathode”意为阳极 |
| B.该装置在室温下合成氨的同时,还将电能转化为化学能 |
| C.“Cathode”电极上发生反应为N2+6e-+6H+=2NH3 |
| D.若该电池的效率为100%,则每生成标况下22.4LH2,可消耗30.8kJ电能 |
| A.该反应在常温下能自发进行的主要原因是ΔS>0 |
| B.反应的平衡常数可表示为K= |
| C.若有2molNO参加反应,足够长的时间后,可放出116.4kJ的热量 |
| D.反应物的键能和小于生成物的键能和 |
| A.加水稀释,氨水中所有的离子浓度都减小 |
| B.加水稀释,氨水的电离平衡正向移动, |
| C.加入浓氨水,氨水的电离平衡正向移动,NH3·H2O的电离度增大 |
| D.加入浓氨水,水的电离平衡逆向移动,c(H+)·c(OH-)不变 |
在高温或放电条件下,N2和O2反应生成NO,NO进一步氧化生成NO2。NH3是一种重要的化工原料,主要用于化肥工业,也广泛用于硝酸、纯碱等工业,合成氨反应为N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。通过催化还原的方法,可将烟气和机动车尾气中的NO转化为N2,也可将水体中的
2NH3(g) ΔH=-92.4 kJ·mol-1。通过催化还原的方法,可将烟气和机动车尾气中的NO转化为N2,也可将水体中的 转化为N2。在指定条件下,下列选项所示的物质间转化能实现的是
转化为N2。在指定条件下,下列选项所示的物质间转化能实现的是
| A.NO(g) | B.N2(g) |
| C.NO(g) | D.NH3 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


