单选题 适中0.65 引用4 组卷667
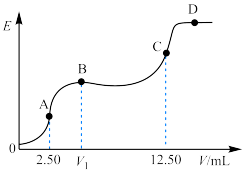
某温度下25mL含KCl和KCN的溶液,用0.1000mol·L-1的硝酸银标准溶液对该混合液进行电位滴定(CN-与H+的反应可以忽略),获得电动势(E)和硝酸银标准溶液体积(V)的电位滴定曲线如图所示,曲线上的转折点即为化学计量点。
已知:I、Ag+与CN-反应过程为:①Ag++2CN-=[Ag(CN)2]-、②[Ag(CN)2]-+Ag+=2AgCN↓
II、该温度时,Ksp(AgCN)=2×10-16,Ksp(AgCl)=2×10-10。
下列说法不正确的是

已知:I、Ag+与CN-反应过程为:①Ag++2CN-=[Ag(CN)2]-、②[Ag(CN)2]-+Ag+=2AgCN↓
II、该温度时,Ksp(AgCN)=2×10-16,Ksp(AgCl)=2×10-10。
下列说法不正确的是
| A.V1=5.00,B点时生成AgCN |
| B.c(KCN)=0.02000mol·L-1,c(KCl)=0.03000mol·L-1 |
| C.反应①的平衡常数为K1,反应②的平衡常数为K2,则K1×K2= |
| D.C点时,溶液中 |
21-22高三上·福建福州·阶段练习
类题推荐
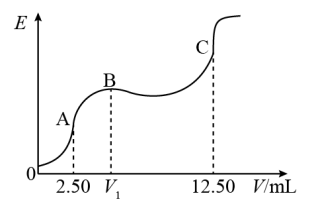
某温度下,25mL含KX和KY的混合溶液,用0.1000mol•L-1的硝酸银标准溶液对该混合液进行电位滴定(在滴定过程中,随着滴定剂的不断加入,电极电位E不断发生变化,电极电位发生突跃时,说明滴定到达终点)、获得电动势(E)和银硝酸银标准溶液体积(V)的电位滴定曲线如图所示。
已知:
I.Ag+与Y-反应过程为:①Ag++2Y- [AgY2]-、②[AgY2]-+Ag+
[AgY2]-、②[AgY2]-+Ag+ 2AgY↓。
2AgY↓。
II.该温度下,Ksp(AgY)=2×10-16,Ksp(AgX)=2×10-10
III.Y-与H+的反应可以忽略。
下列说法不正确的是

已知:
I.Ag+与Y-反应过程为:①Ag++2Y-
II.该温度下,Ksp(AgY)=2×10-16,Ksp(AgX)=2×10-10
III.Y-与H+的反应可以忽略。
下列说法不正确的是
| A.若HY为弱酸,则从开始到A点,水的电离程度不断减小 |
| B.原混合溶液中c(KX)=0.02000mol•L-1,c(KY)=0.03000mol•L-1 |
| C.若反应①的平衡常数为K1,反应②的平衡常数为K2,则 |
| D.将AgX和AgY的饱和溶液等体积混合,加入足量硝酸银溶液,析出固体AgX多于AgY |
配离子的稳定性可用K不稳衡量,如[Ag(NH3)2]+的 ,一 定温度下,向0.1mo/L硝酸银溶液中滴入稀氨水,发生反应Ag++2NH3
,一 定温度下,向0.1mo/L硝酸银溶液中滴入稀氨水,发生反应Ag++2NH3 [Ag(NH3)2]+, 溶液中pNH3与δ(X)的关系如图所示,其中pNH3=- lg(NH3)、δ(X)=
[Ag(NH3)2]+, 溶液中pNH3与δ(X)的关系如图所示,其中pNH3=- lg(NH3)、δ(X)=  (X代表Ag+或[Ag(NH3)2]+)。已知该温度下Ksp(AgCl)= 1.6 × 10-10,下列说法正确的是
(X代表Ag+或[Ag(NH3)2]+)。已知该温度下Ksp(AgCl)= 1.6 × 10-10,下列说法正确的是
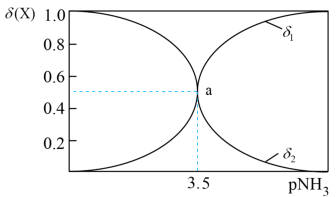
| A.图中δ2代表的是δ(Ag+) |
| B.该溶液中c(Ag+)+c[Ag(NH3)2]++c(NH |
| C.向该溶液中滴入稀硝酸,δ[Ag(NH3)2 ]+增大 |
| D.AgCl 溶于氨水时AgCl+2NH3 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网