解答题-原理综合题 较难0.4 引用2 组卷318
“绿水青山就是金山银山”,研究消除氮氧化物污染对建设美丽家乡,打造宜居环境有重要意义。
(1)已知:2NO(g)+O2(g)=2NO2(g) △H1=-114kJ/mol
C(s)+O2(g)=CO2(g) △H2=-393.5kJ/mol
N2(g)+O2(g)=2NO(g) △H3=+181kJ/mol
若某反应的平衡常数表达式为K= ,该反应的热化学方程式为
,该反应的热化学方程式为___________ 。
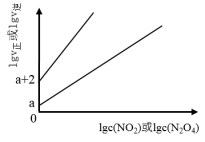
(2)T℃时,存在如下平衡:2NO2(g) N2O4(g)。该反应正、逆反应速率与NO2、N2O4的浓度关系为:v正=k正c2(NO2),v逆=k逆c(N2O4)(k正、k逆是速率常数),且lgv正~lgc(NO2)与lgv逆~lgc(N2O4)的关系如图所示。
N2O4(g)。该反应正、逆反应速率与NO2、N2O4的浓度关系为:v正=k正c2(NO2),v逆=k逆c(N2O4)(k正、k逆是速率常数),且lgv正~lgc(NO2)与lgv逆~lgc(N2O4)的关系如图所示。
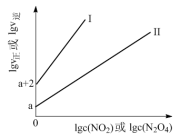
①图中表示lgv正~lgc(NO2)的线是___________ (填“I”或“II”)。
②T℃时,往刚性容器中充入一定量NO2,平衡后测得c(N2O4)为1.0mol/L,则平衡时,v逆=______ (用含a的表达式表示)。
③T℃时,该反应的平衡常数K=___________ L/mol。
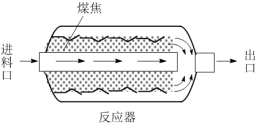
(3)原煤经热解、冷却得到的煤焦可用于NO的脱除。将浓度恒定的NO废气以固定流速通过下图的反应器。分别用两种不同热解温度的煤焦,测定NO的脱除率。
已知:i.两种不同热解温度500℃、900℃下获得的煤焦分别用S—500、S—900表示。
ii.煤焦表面存在的官能团有利于NO的吸附。热解温度高,煤焦 比值小,表面官能团少。
比值小,表面官能团少。
iii.NO的脱除主要含吸附和化学还原两个过程。
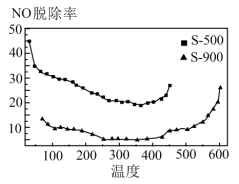
①由图可知:相同温度下,S—500对NO的脱除率比S—900的高,结合表格数据分析其可能原因是_______ 、______ 。
②由图可知:350℃后,随着温度升高,NO的脱除率增大的原因是___________ 。
(1)已知:2NO(g)+O2(g)=2NO2(g) △H1=-114kJ/mol
C(s)+O2(g)=CO2(g) △H2=-393.5kJ/mol
N2(g)+O2(g)=2NO(g) △H3=+181kJ/mol
若某反应的平衡常数表达式为K=
(2)T℃时,存在如下平衡:2NO2(g)

①图中表示lgv正~lgc(NO2)的线是
②T℃时,往刚性容器中充入一定量NO2,平衡后测得c(N2O4)为1.0mol/L,则平衡时,v逆=
③T℃时,该反应的平衡常数K=
(3)原煤经热解、冷却得到的煤焦可用于NO的脱除。将浓度恒定的NO废气以固定流速通过下图的反应器。分别用两种不同热解温度的煤焦,测定NO的脱除率。

已知:i.两种不同热解温度500℃、900℃下获得的煤焦分别用S—500、S—900表示。
ii.煤焦表面存在的官能团有利于NO的吸附。热解温度高,煤焦
iii.NO的脱除主要含吸附和化学还原两个过程。

①由图可知:相同温度下,S—500对NO的脱除率比S—900的高,结合表格数据分析其可能原因是
| 煤焦 | 元素分析(%) | 比表面积 (cm2∙g-1) | |
| H | C | ||
| S-500 | 2.76 | 80.79 | 105.69 |
| S-900 | 0.82 | 84.26 | 8.98 |
②由图可知:350℃后,随着温度升高,NO的脱除率增大的原因是
21-22高三上·黑龙江哈尔滨·期末
类题推荐
“绿水青山就是金山银山”,研究消除氮氧化物污染对建设美丽家乡,打造宜居环境有重要意义。
(1)已知:2NO(g)+O2(g)=2NO2(g) ΔH1=-114kJ/mol


写出C与 反应生成
反应生成 的热化学方程式:
的热化学方程式:___________ 。
(2)已知: 。在2L恒容密闭容器中,投入
。在2L恒容密闭容器中,投入 和0.4moLCO,经过一段时间后达到平衡状态,测得CO的转化率为50%。该温度下,反应的平衡常数为
和0.4moLCO,经过一段时间后达到平衡状态,测得CO的转化率为50%。该温度下,反应的平衡常数为___________ 。
(3)原煤经热解、冷却得到的煤焦可用于NO的脱除。热解温度为 得到的煤焦分别用
得到的煤焦分别用 表示,相关信息如下表:
表示,相关信息如下表:
将NO浓度恒定的废气以固定流速通过反应器(图1)。不同温度下,测定相同时间内NO的出口浓度,可得NO的脱除率与温度的关系如图2所示。[已知:NO的脱除主要包含吸附和化学还原( )两个过程]
)两个过程]

①已知煤焦表面存在的官能团有利于吸附NO,其数量与煤焦中氢碳质量比的值密切相关,比值小,表面官能团少。由图2可知,相同温度下,单位时间内 对NO的脱除率比
对NO的脱除率比 的高,可能原因是
的高,可能原因是___________ 。(答两条)。
② 后,随着温度升高,单位时间内NO的脱除率增大的原因是
后,随着温度升高,单位时间内NO的脱除率增大的原因是___________ 。
(4)电解氧化吸收法:其原理如图3所示。从A口中出来的物质的是___________ 。电解池阴极的电极反应式为___________ 。

(5)一定条件,反应 的反应历程如图4所示,该历程分步进行,其中第
的反应历程如图4所示,该历程分步进行,其中第___________ 步是决速步骤。在恒温恒容密闭容器中进行上述反应,原料组成 ,体系达到平衡时
,体系达到平衡时 的体积分数为
的体积分数为 ,则
,则 的平衡转化率=
的平衡转化率=___________ 。

(1)已知:2NO(g)+O2(g)=2NO2(g) ΔH1=-114kJ/mol
写出C与
(2)已知:
(3)原煤经热解、冷却得到的煤焦可用于NO的脱除。热解温度为
| 煤焦 | 元素分析/% | 比表面积/ | |
| C | H | ||
| 80.79 | 2.76 | 105.69 | |
| 84.26 | 0.82 | 8.98 | |

①已知煤焦表面存在的官能团有利于吸附NO,其数量与煤焦中氢碳质量比的值密切相关,比值小,表面官能团少。由图2可知,相同温度下,单位时间内
②
(4)电解氧化吸收法:其原理如图3所示。从A口中出来的物质的是

(5)一定条件,反应

研究消除废气污染对建设美丽家乡,打造宜居环境有重要意义。
(1)已知:工业废气中的氮氧化物可用以下反应去除,常温常压下(298K,100kPa),以下反应的焓变和熵变如表1所示:
①
②
③
表1:
结合表1中的数据,工业上,反应___________ (填反应编号)不可用于常温常压下去除氮氧化物,请通过计算说明理由:___________ 。
(2)治理排出的尾气(含CO、 、NO)的方法可在密闭容器中发生如下反应:
、NO)的方法可在密闭容器中发生如下反应:
I.
Ⅱ.
一定温度下,向体积为2L的恒容的密闭容器中,充入4molCO、2molNO、2mol 发生上述反应,达到平衡状态时,测得
发生上述反应,达到平衡状态时,测得 的物质的量为0.4mol,且体系中
的物质的量为0.4mol,且体系中 的物质的量比
的物质的量比 的多0.8mol,则该温度下达平衡时,反应Ⅱ的平衡常数K=
的多0.8mol,则该温度下达平衡时,反应Ⅱ的平衡常数K=___________ L/mol。
(3)原煤经热解、冷却得到的煤焦可用于NO的脱除。热解温度为500℃,900℃得到的煤焦分别用S-500、S-900表示,相关信息如下表:
将NO浓度恒定的废气以固定流速通过反应器(图1)。不同温度下,进行多组平行实验,测定相同时间内NO的出口浓度,可得NO的脱除率与温度的关系如图2所示。
[已知:NO的脱除主要包含吸附和化学还原( )两个过程]
)两个过程]
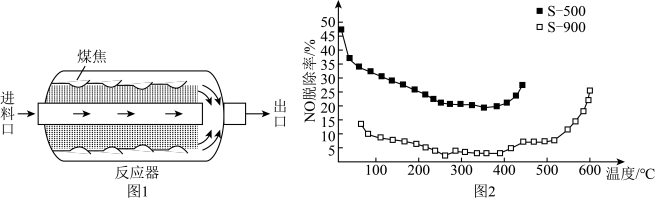
①已知煤焦表面存在的官能团有利于吸附NO,其数量与煤焦中氢碳质量比的值密切相关,比值小,表面官能团少。由图2可知,相同温度下,一单位时间内S-500对NO的脱除率比S-900的高,可能原因是___________ 。(答两条)。
②350℃后,随着温度升高,单位时间内NO的脱除率增大的原因是___________ 。
(4)电解氧化吸收法:其原理如图所示:

①从A口中出来的物质的是___________ 。
②写出电解池阴极的电极反应式___________ 。
(1)已知:工业废气中的氮氧化物可用以下反应去除,常温常压下(298K,100kPa),以下反应的焓变和熵变如表1所示:
①
②
③
表1:
| 反应 | 焓变(kJ/mol) | 熵变( |
| ① | -163 | +22.6 |
| ② | +112.7 | +150 |
| ③ | -67.8 | +120 |
(2)治理排出的尾气(含CO、
I.
Ⅱ.
一定温度下,向体积为2L的恒容的密闭容器中,充入4molCO、2molNO、2mol
(3)原煤经热解、冷却得到的煤焦可用于NO的脱除。热解温度为500℃,900℃得到的煤焦分别用S-500、S-900表示,相关信息如下表:
| 煤焦 | 元素分析/% | 比表面积/ | |
| C | H | ||
| S-500 | 80.79 | 2.76 | 105.69 |
| S-900 | 84.26 | 0.82 | 8.98 |
[已知:NO的脱除主要包含吸附和化学还原(

①已知煤焦表面存在的官能团有利于吸附NO,其数量与煤焦中氢碳质量比的值密切相关,比值小,表面官能团少。由图2可知,相同温度下,一单位时间内S-500对NO的脱除率比S-900的高,可能原因是
②350℃后,随着温度升高,单位时间内NO的脱除率增大的原因是
(4)电解氧化吸收法:其原理如图所示:

①从A口中出来的物质的是
②写出电解池阴极的电极反应式
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网