解答题-工业流程题 适中0.65 引用1 组卷174
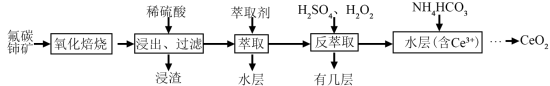
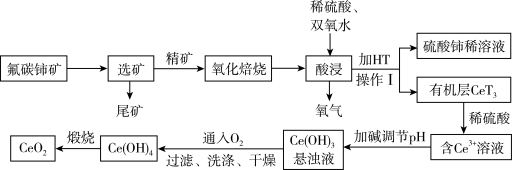
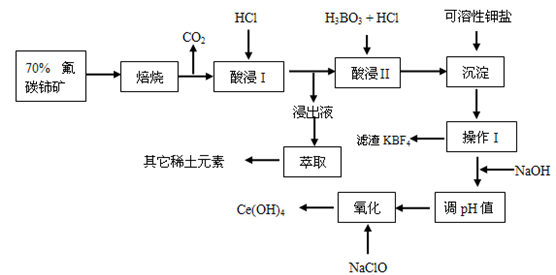
稀土有工业“黄金”之称,我国稀土资源丰富。目前从氟碳铈矿(主要含CeFCO3)为原料制备CeO2的一种工艺流程如下:
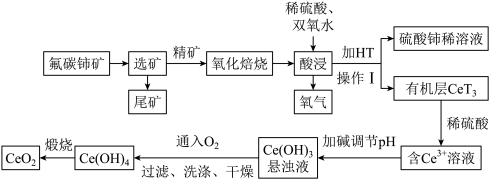
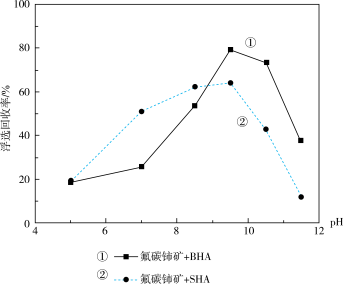
(1)选矿是整个矿产品生产过程中的重要环节。一般可采用重选法、浮选法、磁选法、电选法等方法,将有用矿物与脉石矿物(无用矿物)分离。氟碳铈矿浮选过程中采用不同捕收剂BHA和SHA(浓度均为2×10-4mol/L)时,pH值对氟碳铈矿浮选回收率的影响如图所示。浮选时应选择的最佳捕收剂是___________ (填“BHA”或“SHA”),其对应的最佳pH值为___________ 。
(2)CeFCO3中Ce的化合价为___________ 。
(3)在空气中进行氧化焙烧时由于水蒸气的参与,可产生一种有毒并对陶瓷设备有腐蚀作用的气体,其化学式为____ 。
(4)氧化焙烧后的产物之一为CeO2,则酸浸时发生反应的离子方程式为___________ 。
(5)为了提高酸浸率,可以适当提高反应温度,但若温度偏高浸出率反而会减小,其原因是___________ 。
(6)HT是一种有机萃取剂,则操作I的名称为___________ 。
(7)写出向Ce(OH)3悬浊液中通入氧气得到Ce(OH)4的化学方程式:___________ 。
(8)CeO2是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧。在尾气消除过程中发生着CeO2⇌CeO2(1-x)+xO2↑(0≤x≤0.25)的循环。利用CeO2消除CO尾气后,CeO2(1-x)中Ce的化合价为+3价、+4价。若x=0.2,则Ce(III)与Ce(IV)的原子个数比为___________ 。

(1)选矿是整个矿产品生产过程中的重要环节。一般可采用重选法、浮选法、磁选法、电选法等方法,将有用矿物与脉石矿物(无用矿物)分离。氟碳铈矿浮选过程中采用不同捕收剂BHA和SHA(浓度均为2×10-4mol/L)时,pH值对氟碳铈矿浮选回收率的影响如图所示。浮选时应选择的最佳捕收剂是

(2)CeFCO3中Ce的化合价为
(3)在空气中进行氧化焙烧时由于水蒸气的参与,可产生一种有毒并对陶瓷设备有腐蚀作用的气体,其化学式为
(4)氧化焙烧后的产物之一为CeO2,则酸浸时发生反应的离子方程式为
(5)为了提高酸浸率,可以适当提高反应温度,但若温度偏高浸出率反而会减小,其原因是
(6)HT是一种有机萃取剂,则操作I的名称为
(7)写出向Ce(OH)3悬浊液中通入氧气得到Ce(OH)4的化学方程式:
(8)CeO2是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧。在尾气消除过程中发生着CeO2⇌CeO2(1-x)+xO2↑(0≤x≤0.25)的循环。利用CeO2消除CO尾气后,CeO2(1-x)中Ce的化合价为+3价、+4价。若x=0.2,则Ce(III)与Ce(IV)的原子个数比为
21-22高三上·黑龙江哈尔滨·期末
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 Ce(H2a-4A2a)+4H+。 用D 表示Ce4+分别在有机层中与水层中存在形式的浓度之比(D=
Ce(H2a-4A2a)+4H+。 用D 表示Ce4+分别在有机层中与水层中存在形式的浓度之比(D=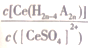 ) 其它条件不变,在浸出液中加入不同量的NaSO4以改变水层中的c(SO42-), D 随浸出液中c(SO42-)增大而减小的原因是
) 其它条件不变,在浸出液中加入不同量的NaSO4以改变水层中的c(SO42-), D 随浸出液中c(SO42-)增大而减小的原因是