解答题-原理综合题 适中0.65 引用1 组卷233
二氧化硫的污染治理是化学家关注的热点问题之一,回答下列问题。
I.二氧化硫的治理。已知25℃时,Kb(NH3·H2O)=1.8×10-5 Ksp(CaSO4)=7.1×10-5 Ka1(H2SO3)=1.5×10-2 Ka2(H2SO3)=1.0×10-7。
(1)亚硫酸盐法。将含二氧化硫的烟气通入1.0mol·L-1的Na2SO3溶液,写出该反应的化学方程式_______ 。若此过程中溶液体积不变,则溶液的pH将_______ (填“减小”“不变”或“增大)。
(2)双碱脱硫法。
第1步:用过量的浓氨水吸收SO2,并在空气中氧化;
第2步:加入石灰水,发生反应Ca2++2OH-+2NH +SO
+SO ⇌CaSO4↓+2NH3·H2O
⇌CaSO4↓+2NH3·H2O
计算第2步反应的K=_______ (填数值,保留2位有效数字)。
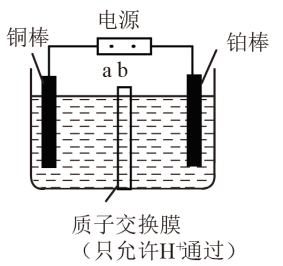
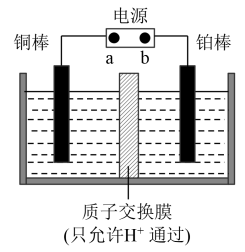
(3)电解法。先用Na2SO4溶液吸收烟气中的SO2,再用离子膜电解法电解吸收液得到单质硫,同时在阳极得到副产物氧气,装置如图所示。

①b为电源的_______ (填“正极”或“负极”)。
②用Na2SO4溶液代替水吸收烟气中的SO2,目的是_______ 。
③若电解一段时间后通过质子交换膜的离子数为1.204×1024个,则通过处理烟气理论上能得到硫_______ kg。
II.二氧化硫的转化。
(4)适当调控硫酸工业的反应条件可提高二氧化硫的转化率,减少其排放。已知,对于放热的可逆反应,某一给定转化率下,最大反应速率对应的温度称为最适宜温度。在图中画出反应2SO2(g)+O2(g)⇌2SO3(g)的转化率与最适宜温度(曲线a)、平衡转化率与温度(曲线b)的关系曲线示意图(标明曲线 a 、 b )_______ 。

I.二氧化硫的治理。已知25℃时,Kb(NH3·H2O)=1.8×10-5 Ksp(CaSO4)=7.1×10-5 Ka1(H2SO3)=1.5×10-2 Ka2(H2SO3)=1.0×10-7。
(1)亚硫酸盐法。将含二氧化硫的烟气通入1.0mol·L-1的Na2SO3溶液,写出该反应的化学方程式
(2)双碱脱硫法。
第1步:用过量的浓氨水吸收SO2,并在空气中氧化;
第2步:加入石灰水,发生反应Ca2++2OH-+2NH
计算第2步反应的K=
(3)电解法。先用Na2SO4溶液吸收烟气中的SO2,再用离子膜电解法电解吸收液得到单质硫,同时在阳极得到副产物氧气,装置如图所示。

①b为电源的
②用Na2SO4溶液代替水吸收烟气中的SO2,目的是
③若电解一段时间后通过质子交换膜的离子数为1.204×1024个,则通过处理烟气理论上能得到硫
II.二氧化硫的转化。
(4)适当调控硫酸工业的反应条件可提高二氧化硫的转化率,减少其排放。已知,对于放热的可逆反应,某一给定转化率下,最大反应速率对应的温度称为最适宜温度。在图中画出反应2SO2(g)+O2(g)⇌2SO3(g)的转化率与最适宜温度(曲线a)、平衡转化率与温度(曲线b)的关系曲线示意图(

21-22高三上·山东·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 CaSO4↓+2NH3·H2O。
CaSO4↓+2NH3·H2O。
 SO3(g)+O2(g)
SO3(g)+O2(g)


