解答题-实验探究题 适中0.65 引用1 组卷746
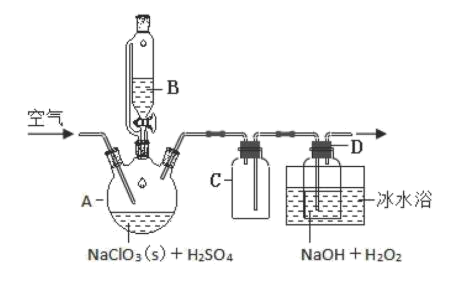
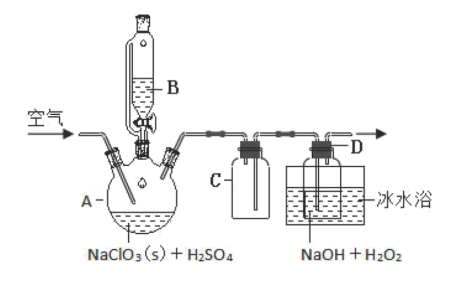
随着新型冠状病毒感染的肺炎确诊病例越来越多,消毒已成了人们关注的话题。前不久李兰娟院士说过新冠病毒的几个弱点,比如含氯的消毒剂就可以有效的灭活病毒。某校化学兴趣小组为制备并收集氯气,设计下图装置,装置中的夹持装置和加热装置均已略去。
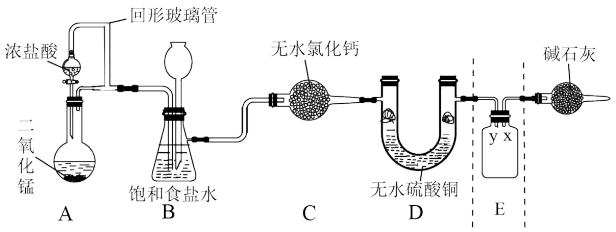
回答下列问题:
(1)写出盛放浓盐酸的仪器名称_______ ,回形玻璃管的作用是_______ 。
(2)写出装置A中发生反应的化学方程式_______ 。
(3)装置C的作用是_______ 。
(4)E装置中导管_______ (填“x”或“y”)应伸至靠近集气瓶底部。
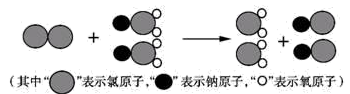
(5)ClO2是目前国际上公认的新一代高效、广谱、安全的杀菌、保鲜剂,在水处理等方面具有广泛的应用。与Cl2相比,ClO2不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。
①我国最近成功研制出制取ClO2的新方法,其反应的微观过程如图所示:
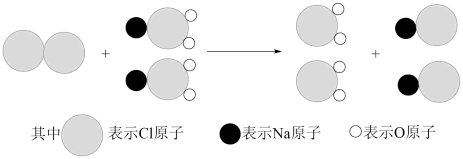
该反应的化学方程式_______ 。
②将ClO2通入酸性淀性粉碘化钾溶液,溶液变成蓝色,ClO2被还原为氯离子,该反应的离子方程式为:_______ 。

回答下列问题:
(1)写出盛放浓盐酸的仪器名称
(2)写出装置A中发生反应的化学方程式
(3)装置C的作用是
(4)E装置中导管
(5)ClO2是目前国际上公认的新一代高效、广谱、安全的杀菌、保鲜剂,在水处理等方面具有广泛的应用。与Cl2相比,ClO2不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。
①我国最近成功研制出制取ClO2的新方法,其反应的微观过程如图所示:

该反应的化学方程式
②将ClO2通入酸性淀性粉碘化钾溶液,溶液变成蓝色,ClO2被还原为氯离子,该反应的离子方程式为:
20-21高一上·辽宁沈阳·期末
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网