解答题-原理综合题 适中0.65 引用1 组卷179
CO2的捕获和利用技术对减缓日益严重的环境问题有重要意义。利用CO2加氢制CH3OH的过程中,主要发生的化学反应如下:
①CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)  =+49.5kJ
=+49.5kJ
②CO2(g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g)  =-40.9kJ
=-40.9kJ
完成下列填空:
(1)反应②达到平衡后,其他条件不变,升高温度,v正__ v逆(选填“>”或“<”)。
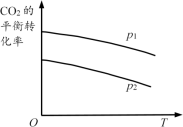
(2)在1L密闭容器中通入1molCO2和3molH2,发生上述反应,CO2的平衡转化率随温度和压强的变化如图所示。比较压强大小:p1_ p2(选填“>”或“<”)。
某温度下达到平衡时,容器中的n(CH3OH)=0.3mol、n(CO)=0.3mol。达到平衡所需时间tmin,则0~tmin内CH3OH平均反应速率v(CH3OH)=__ ;反应②的平衡常数K的数值为__ 。
工业废气中的CO2可用氨水捕获,生成NH4HCO3溶液。
(3)常温下,0.1mol·L-1的NH4HCO3溶液的pH≈8,请解释原因__ 。
(4)常温下,将等体积、等物质的量浓度的NH4HCO3溶液与NaCl溶液充分混合后静置,发现有沉淀析出,则沉淀的化学式为__ ;比较上层清液中的离子浓度关系:c(H+)+c(NH )
)___ c(OH-)+c(HCO )+2c(CO
)+2c(CO )(选填“>”“<”或“=”)。
)(选填“>”“<”或“=”)。
①CO2(g)+3H2(g)
②CO2(g)+H2(g)
完成下列填空:
(1)反应②达到平衡后,其他条件不变,升高温度,v正
(2)在1L密闭容器中通入1molCO2和3molH2,发生上述反应,CO2的平衡转化率随温度和压强的变化如图所示。比较压强大小:p1

某温度下达到平衡时,容器中的n(CH3OH)=0.3mol、n(CO)=0.3mol。达到平衡所需时间tmin,则0~tmin内CH3OH平均反应速率v(CH3OH)=
工业废气中的CO2可用氨水捕获,生成NH4HCO3溶液。
(3)常温下,0.1mol·L-1的NH4HCO3溶液的pH≈8,请解释原因
(4)常温下,将等体积、等物质的量浓度的NH4HCO3溶液与NaCl溶液充分混合后静置,发现有沉淀析出,则沉淀的化学式为
2022·上海金山·一模
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


 =6,则FexOy的化学式为
=6,则FexOy的化学式为 CH3OCH3(g)+3H2O(g) ΔH=-130.8 kJ·mol-1
CH3OCH3(g)+3H2O(g) ΔH=-130.8 kJ·mol-1


