填空题 困难0.15 引用1 组卷937
德国人哈伯在1905年发明了合成氨的方法,其合成原理为:N2(g)+3H2(g)⇌2NH3(g) △H=-92.4kJ·mol-1,他因此获得了1918年诺贝尔化学奖。合成氨技术的创立开辟了人工固氮的重要途径,解决了亿万人口生存问题。请回答下列问题:
(1)某化学研究性学习小组模拟工业合成氨的反应。在容积固定为2L的密闭容器内充入1molN2和3molH2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下表:
则从反应开始到25min时,以H2表示的平均反应速率=_______ 。
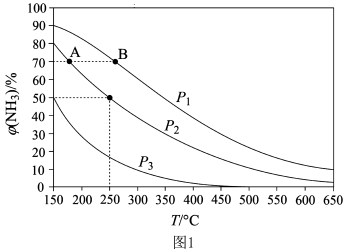
(2)合成氨反应N2(g)+3H2(g)⇌2NH3(g),初始时氮气、氢气的体积比为1:3,在相同催化剂条件下平衡混合物中氨的体积分数φ(NH3)与温度、压强的关系如图所示。则:
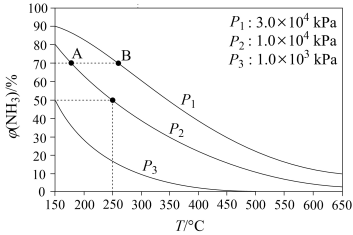
A、B两点的化学反应速率较大的是_______ (填“A点”或“B点”)。在250°C、1.0×104kPa下,化学平衡常数表达式为K=_______ 。
(3)随着温度升高,单位时间内NH3的产率增大,温度高于900°C以后,单位时间内NH3的产率开始下降的原因可能是:升高温度催化剂活性降低;_______ 。
(4)工业上可以利用氨气生产氢氰酸(HCN)的反应为:NH3(g)+CH4(g)⇌3H2(g)+HCN(g) ΔH>0,在其他条件一定,该反应达到平衡时NH3转化率随外界条件Y变化的关系如图所示,Y代表_______ (填字母代号)。
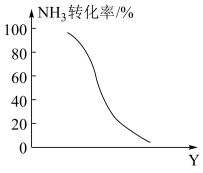
A.原料中CH4与NH3的体积比 B.温度 C.压强
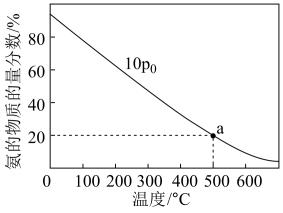
(5)工业合成氨反应为:N2(g)+3H2(g)⇌2NH3(g),当进料体积比V(N2):V(H2)=1:3时,平衡气体中NH3的物质的量分数随温度和压强变化的关系如图所示:500°C、压强为10P0时,Kp=_______ [Kp为平衡分压代替平衡浓度计算求得的平衡常数(分压=总压×物质的量分数),用P0的代数式表示]。
(6)我国科研人员发现在反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)使用Pt单原子催化剂有着高达90%以上的甲醇选择性。反应历程如下图,其中TS表示过渡态,吸附在催化剂表面上的物种用*表示。
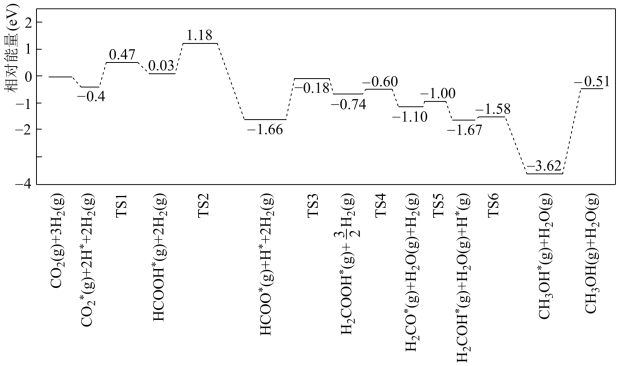
上述能垒(活化能)为1.15eV的反应为_______ 。
(1)某化学研究性学习小组模拟工业合成氨的反应。在容积固定为2L的密闭容器内充入1molN2和3molH2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下表:
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
(2)合成氨反应N2(g)+3H2(g)⇌2NH3(g),初始时氮气、氢气的体积比为1:3,在相同催化剂条件下平衡混合物中氨的体积分数φ(NH3)与温度、压强的关系如图所示。则:

A、B两点的化学反应速率较大的是
(3)随着温度升高,单位时间内NH3的产率增大,温度高于900°C以后,单位时间内NH3的产率开始下降的原因可能是:升高温度催化剂活性降低;
(4)工业上可以利用氨气生产氢氰酸(HCN)的反应为:NH3(g)+CH4(g)⇌3H2(g)+HCN(g) ΔH>0,在其他条件一定,该反应达到平衡时NH3转化率随外界条件Y变化的关系如图所示,Y代表

A.原料中CH4与NH3的体积比 B.温度 C.压强
(5)工业合成氨反应为:N2(g)+3H2(g)⇌2NH3(g),当进料体积比V(N2):V(H2)=1:3时,平衡气体中NH3的物质的量分数随温度和压强变化的关系如图所示:500°C、压强为10P0时,Kp=

(6)我国科研人员发现在反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)使用Pt单原子催化剂有着高达90%以上的甲醇选择性。反应历程如下图,其中TS表示过渡态,吸附在催化剂表面上的物种用*表示。

上述能垒(活化能)为1.15eV的反应为
21-22高二上·湖南·阶段练习
类题推荐
合成氨技术的创立开辟了人工固氮的重要途径,其原理为:
 。请回答下列问题:
。请回答下列问题:
(1)某化学研究性学习小组模拟工业合成氨的反应。在容积固定为2L的密闭容器内充入1molN2和3molH2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,其气体总物质的量随时间变化如下表:
则从反应开始到25min时,以H2表示的平均反应速率=___________ 。
(2)合成氨反应 ,初始时氮气、氢气的体积比为1:3,在相同催化剂条件下平衡混合物中氨的体积分数
,初始时氮气、氢气的体积比为1:3,在相同催化剂条件下平衡混合物中氨的体积分数 与温度、压强的关系如图1所示。p1、p2、p3由大到小排序
与温度、压强的关系如图1所示。p1、p2、p3由大到小排序___________ ; A、B两点的化学反应速率较大的是___________ (填“A点”或“B点”)。
(3)在合成氨工业中,要使氨的平衡产率增大,同时又能提高反应速率,可采取的措施有___________ (填编号)。
①使用催化剂
②恒温恒容,增大原料气N2和H2充入量
③升高温度④恒温恒容,充入惰性气体Ar使压强增大
(4)工业上可以利用氨气生产氢氰酸(HCN)的反应为:
 ,在其他条件一定,该反应达到平衡时NH3转化率随外界条件Y变化的关系如图2所示,Y代表
,在其他条件一定,该反应达到平衡时NH3转化率随外界条件Y变化的关系如图2所示,Y代表___________ (填字母代号)。
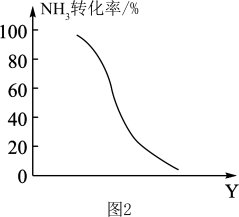
A.原料中CH4与NH3的体积比 B.温度 C.压强
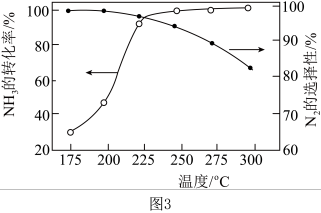
(5)NH3与O2作用分别生成N2、NO、N2O的反应均为放热反应。工业尾气中的NH3可通过催化氧化为N2除去。将一定比例的NH3、O2和N2的混合气体以一定流速经过装有催化剂的反应管,NH3的转化率、N2的选择性 与温度的关系如图3。其他条件不变,在175~300℃范围内升高温度,出口处氮氧化物的量
与温度的关系如图3。其他条件不变,在175~300℃范围内升高温度,出口处氮氧化物的量___________ (填“增大”或“减小”),NH3的平衡转化率___________ (填“增大”或“减小”)。
(1)某化学研究性学习小组模拟工业合成氨的反应。在容积固定为2L的密闭容器内充入1molN2和3molH2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,其气体总物质的量随时间变化如下表:
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| 气体总物质的量/mol | 4 | 3.52 | 3.3 | 3.16 | 3.06 | 3 | 3 |
(2)合成氨反应

(3)在合成氨工业中,要使氨的平衡产率增大,同时又能提高反应速率,可采取的措施有
①使用催化剂
②恒温恒容,增大原料气N2和H2充入量
③升高温度④恒温恒容,充入惰性气体Ar使压强增大
(4)工业上可以利用氨气生产氢氰酸(HCN)的反应为:

A.原料中CH4与NH3的体积比 B.温度 C.压强
(5)NH3与O2作用分别生成N2、NO、N2O的反应均为放热反应。工业尾气中的NH3可通过催化氧化为N2除去。将一定比例的NH3、O2和N2的混合气体以一定流速经过装有催化剂的反应管,NH3的转化率、N2的选择性

氮及其化合物是氮肥工业等无机化工的重要原料。
(1)某化学研究性学习小组模拟工业合成氨的反应。在容积固定为2L的密闭容器内充入1molN2和3molH2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如表:
则从反应开始到25min时,以N2表示的平均反应速率=_______ 。
(2)一定温度下,向一个容积为2L的密闭容器中通入2molN2和7molH2,达到平衡时测得容器的压强为起始时的7/9倍,在同一温度,同一容器中,将起始物质改为amolN2,bmolH2,cmolNH3(a,b,c均不为零)欲使平衡混合物中各物质的质量与原平衡相同,且反应在起始时向逆反应方向进行,c的取值范围是_______ 。
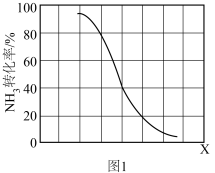
(3)工业上利用氨气生产氢氰酸(HCN)的反应为:CH4(g)+NH3(g)⇌HCN(g)+3H2(g) ∆H>0,在其他条件一定,该反应达到平衡时NH3转化率随外界条件X变化的关系如图1所示,X代表_______(填字母代号)。
(4)在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)⇌2NO2(g),随温度升高,混合气体的颜色变深。100℃时达到平衡后,改变反应温度为T,c(N2O4)逐渐减小,经10s又达到平衡。T_______ 100℃(填“大于”“小于”)。温度T时反应达平衡后,将反应容器的容积减少一半,平衡向_______ (填“正反应”或“逆反应”)方向移动,判断理由是_______ 。
(5)已知2NO(g)+O2(g)⇌2NO2(g)∆H的反应历程分两步:
①2NO(g)⇌N2O2(g)(快) ∆H1<0,v1正=k1正c2(NO),v1逆=k1逆c2(N2O2)
②N2O2(g)+O2(g)⇌2NO2(g)(慢) ∆H2<0,v2正=k2正c2(N2O2)·c(O2),v2逆=k2逆c2(NO2)
比较反应①的活化能E1与反应②的活化能E2的大小:E1_______ E2(填“>”、“<”或“=”)其判断理由是_______ ;2NO(g)+O2(g)⇌2NO2(g)的平衡常数K与上述反应速率常数k1正、k1逆、k2正、k2逆的关系式为_______ 。
(6)以乙烯(C2H4)作为还原剂脱硝(NO),其脱硝机理如图2所示,若反应中n(NO):n(O2)=2:1,则总反应的化学方程式为_______ 。

(1)某化学研究性学习小组模拟工业合成氨的反应。在容积固定为2L的密闭容器内充入1molN2和3molH2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如表:
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
(2)一定温度下,向一个容积为2L的密闭容器中通入2molN2和7molH2,达到平衡时测得容器的压强为起始时的7/9倍,在同一温度,同一容器中,将起始物质改为amolN2,bmolH2,cmolNH3(a,b,c均不为零)欲使平衡混合物中各物质的质量与原平衡相同,且反应在起始时向逆反应方向进行,c的取值范围是
(3)工业上利用氨气生产氢氰酸(HCN)的反应为:CH4(g)+NH3(g)⇌HCN(g)+3H2(g) ∆H>0,在其他条件一定,该反应达到平衡时NH3转化率随外界条件X变化的关系如图1所示,X代表_______(填字母代号)。

| A.温度B.压强C.原料中CH4与NH3的体积比 |
(4)在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)⇌2NO2(g),随温度升高,混合气体的颜色变深。100℃时达到平衡后,改变反应温度为T,c(N2O4)逐渐减小,经10s又达到平衡。T
(5)已知2NO(g)+O2(g)⇌2NO2(g)∆H的反应历程分两步:
①2NO(g)⇌N2O2(g)(快) ∆H1<0,v1正=k1正c2(NO),v1逆=k1逆c2(N2O2)
②N2O2(g)+O2(g)⇌2NO2(g)(慢) ∆H2<0,v2正=k2正c2(N2O2)·c(O2),v2逆=k2逆c2(NO2)
比较反应①的活化能E1与反应②的活化能E2的大小:E1
(6)以乙烯(C2H4)作为还原剂脱硝(NO),其脱硝机理如图2所示,若反应中n(NO):n(O2)=2:1,则总反应的化学方程式为

合成氨工业在国民生产中有重要意义,以下是关于合成氨的有关问题,请回答:
(1)若在一容积为2L的密闭容器中加入0.2mol的N2和0.6mol的H2,在一定条件下发生反应:N2(g)+3H2(g) 2NH3(g) △H<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量0.2mol。则前5分钟的平均反应速率v(N2)=
2NH3(g) △H<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量0.2mol。则前5分钟的平均反应速率v(N2)=____ 。平衡时H2的转化率为____ 。
(2)平衡后,若要提高H2的转化率,可以采取的措施有____ 。
(3)若在0.5L的密闭容器中,一定量的氮气和氢气进行如下反应:N2(g)+3H2(g) 2NH3(g) △H<0,其化学平衡常数K与温度T的关系如表所示:
2NH3(g) △H<0,其化学平衡常数K与温度T的关系如表所示:
请完成下列问题:
①试比较K1、K2的大小,K1____ K2(填“<”、“>”或“=”)。
②下列各项能作为判断该反应达到化学平衡状态的依据是____ 。(填序号字母)。
A.容器内N2、H2、NH3的物质的量浓度之比为1:3:2
B.v(N2)正=3v(H2)逆
C.容器内压强保持不变
D.混合气体的密度保持不变
③400℃时,反应2NH3(g) N2(g)+3H2(g)的化学平衡常数为
N2(g)+3H2(g)的化学平衡常数为____ 。当测得NH3、N2和H2物质的量分别为3mol、2mol和1mol时,则该反应的v(N2)正____ v(N2)逆(填“<”“>”或“=”)。
(4)反应CO(g)+2H2(g)=CH3OH(g) △H<0。在一定条件下,将1molCO和2molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
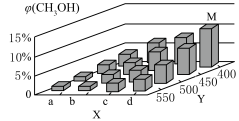
①平衡时,M点CH3OH的体积分数为10%,CO的转化率为____ 。
②X轴上a点的数值比b点____ (填“大”“小”)。某同学认为图中Y轴表示温度,你认为他判断的理由是_____ 。
用化学反应原理研究氮的氧化物和硫的氧化物有着重要的意义。
(5)已知:2SO2(g)+O2(g) 2SO3(g) △H1
2SO3(g) △H1
2NO(g)+O2(g) 2NO2(g) △H2
2NO2(g) △H2
NO2(g)+SO2(g)=SO3(g)+NO(g) △H3
则△H3=____ (用△H1、△H2表示),如果上述三个反应方程式的平衡常数分别为K1、K2、K3,则K3=____ (用K1、K2表示)。
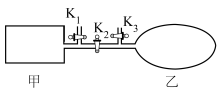
(6)如图所示,甲是恒容的密闭容器,乙是一个体积可变的充气气囊。保持恒温,关闭K2,分别将2molNO和1molO2通过K1、K3分别充入甲、乙中,发生的反应为2NO(g)+O2(g) 2NO2(g)[不考虑2NO2(g)
2NO2(g)[不考虑2NO2(g) N2O4(g)],起始时甲、乙的体积相同均为aL。
N2O4(g)],起始时甲、乙的体积相同均为aL。
①下列说法正确的是_____ 。
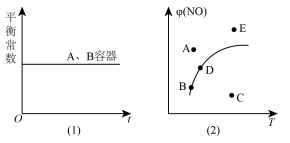
a.甲、乙两容器中气体的颜色均不再发生变化,说明两容器中的反应已达平衡状态
b.甲、乙两容器中NO和O2物质的量浓度比均为2:1时,说明两容器中的反应已达平衡状态
c.甲、乙两容器中平衡常数随时间变化如图(1)所示
d.在其它条件一定时,图(2)中曲线表示反应2NO(g)+O2(g) 2NO2(g) △H>0达平衡时NO的转化率与温度的关系,图上标有A、B、C、D、E点,其中表示未达平衡状态且v正>v逆的点是A或E
2NO2(g) △H>0达平衡时NO的转化率与温度的关系,图上标有A、B、C、D、E点,其中表示未达平衡状态且v正>v逆的点是A或E
②T℃时,甲容器中反应达到平衡时的平衡常数Kp=8×10-2(kPa)-1。若A容器中反应达到平衡时p(NO2)=200kPa,则平衡时NO的转化率为____ 。(Kp是用平衡分压代替平衡浓度计算所得平衡常数,分压=总压×物质的量分数)
(1)若在一容积为2L的密闭容器中加入0.2mol的N2和0.6mol的H2,在一定条件下发生反应:N2(g)+3H2(g)
(2)平衡后,若要提高H2的转化率,可以采取的措施有
| A.加了催化剂 | B.增大容器体积 |
| C.降低反应体系的温度 | D.加入一定量N2 |
(3)若在0.5L的密闭容器中,一定量的氮气和氢气进行如下反应:N2(g)+3H2(g)
| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
①试比较K1、K2的大小,K1
②下列各项能作为判断该反应达到化学平衡状态的依据是
A.容器内N2、H2、NH3的物质的量浓度之比为1:3:2
B.v(N2)正=3v(H2)逆
C.容器内压强保持不变
D.混合气体的密度保持不变
③400℃时,反应2NH3(g)
(4)反应CO(g)+2H2(g)=CH3OH(g) △H<0。在一定条件下,将1molCO和2molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:

①平衡时,M点CH3OH的体积分数为10%,CO的转化率为
②X轴上a点的数值比b点
用化学反应原理研究氮的氧化物和硫的氧化物有着重要的意义。
(5)已知:2SO2(g)+O2(g)
2NO(g)+O2(g)
NO2(g)+SO2(g)=SO3(g)+NO(g) △H3
则△H3=
(6)如图所示,甲是恒容的密闭容器,乙是一个体积可变的充气气囊。保持恒温,关闭K2,分别将2molNO和1molO2通过K1、K3分别充入甲、乙中,发生的反应为2NO(g)+O2(g)

①下列说法正确的是

a.甲、乙两容器中气体的颜色均不再发生变化,说明两容器中的反应已达平衡状态
b.甲、乙两容器中NO和O2物质的量浓度比均为2:1时,说明两容器中的反应已达平衡状态
c.甲、乙两容器中平衡常数随时间变化如图(1)所示
d.在其它条件一定时,图(2)中曲线表示反应2NO(g)+O2(g)
②T℃时,甲容器中反应达到平衡时的平衡常数Kp=8×10-2(kPa)-1。若A容器中反应达到平衡时p(NO2)=200kPa,则平衡时NO的转化率为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


