解答题-工业流程题 适中0.65 引用1 组卷217
某废催化剂主要成分为活性炭和(CH3COO)2Zn,以该废催化剂为原料回收活性炭并制备超细ZnO的实验流程如图:
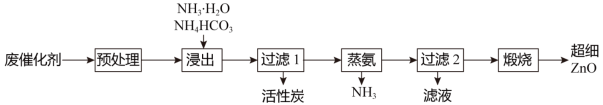
(1)浸出时ZnO转化为[Zn(NH3)4]2+,参加反应的n(NH3•H2O):n(NaHCO3)=3:1,该反应的离子方程式为___ 。
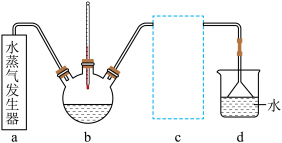
(2)蒸氨时控制温度为95℃左右,在装置 中[Zn(NH3)4]2+转化为碱式碳酸锌沉淀。实验室模拟蒸氨装置如题图所示。
中[Zn(NH3)4]2+转化为碱式碳酸锌沉淀。实验室模拟蒸氨装置如题图所示。
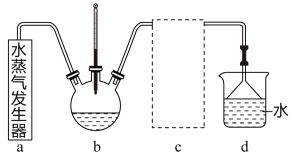
①用水蒸气对装置b加热时,连接装置a、b的导管应插入装置b的位置为___ 。(填序号)
A.液面上方但不接触液面 B.略伸入液面下 C.伸入溶液底部
②在不改变水蒸气的温度、浸出液用量和蒸氨时间的条件下,为提高蒸氨效率和锌的沉淀率,可采取的措施是___ (写出一种)。
(3)46℃、pH约为6.8时,ZnSO4溶液与Na2CO3溶液反应可得碱式碳酸锌。实验室以含少量CuO的ZnO结块废催化剂为原料制备碱式碳酸锌,设计实验方案:___ ,过滤,洗涤,干燥。(须使用的试剂:稀H2SO4、锌粉、Na2CO3溶液)
(4)所回收的活性炭的吸附性能可通过测定其碘吸附值(1g活性炭能够吸附的碘的质量)分析。测量方法如下:
①将活性炭粉碎并干燥,称取0.5000g试样,放入100mL碘量瓶(如题图所示)中,加入10.00mLHCl溶液,加热微沸后冷却至室温,再加入50.00mL0.1mol•L-1I2标准溶液,盖好瓶塞,振荡一段时间,迅速过滤;
②取10.00mL滤液放入另一碘量瓶,加入100mLH2O,用0.1000mol•L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3溶液的体积为10.00mL。计算该样品的碘吸附值___ (mg•g-1)。(写出计算过程,实验过程中溶液的体积变化忽略不计)
已知:I2+S2O =I-+S4O
=I-+S4O (未配平)
(未配平)

(1)浸出时ZnO转化为[Zn(NH3)4]2+,参加反应的n(NH3•H2O):n(NaHCO3)=3:1,该反应的离子方程式为
(2)蒸氨时控制温度为95℃左右,在装置

①用水蒸气对装置b加热时,连接装置a、b的导管应插入装置b的位置为
A.液面上方但不接触液面 B.略伸入液面下 C.伸入溶液底部
②在不改变水蒸气的温度、浸出液用量和蒸氨时间的条件下,为提高蒸氨效率和锌的沉淀率,可采取的措施是
(3)46℃、pH约为6.8时,ZnSO4溶液与Na2CO3溶液反应可得碱式碳酸锌。实验室以含少量CuO的ZnO结块废催化剂为原料制备碱式碳酸锌,设计实验方案:
(4)所回收的活性炭的吸附性能可通过测定其碘吸附值(1g活性炭能够吸附的碘的质量)分析。测量方法如下:

①将活性炭粉碎并干燥,称取0.5000g试样,放入100mL碘量瓶(如题图所示)中,加入10.00mLHCl溶液,加热微沸后冷却至室温,再加入50.00mL0.1mol•L-1I2标准溶液,盖好瓶塞,振荡一段时间,迅速过滤;
②取10.00mL滤液放入另一碘量瓶,加入100mLH2O,用0.1000mol•L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3溶液的体积为10.00mL。计算该样品的碘吸附值
已知:I2+S2O
21-22高三上·江苏常州·阶段练习
类题推荐
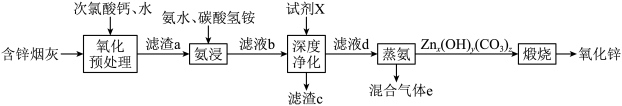
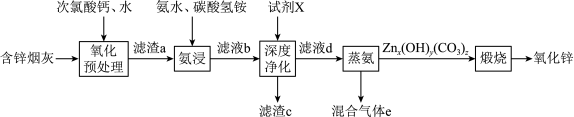
氧化锌在橡胶、油漆涂料、化工、医疗及食品等行业有着广泛应用。一种以含锌烟灰(含有ZnO、CuO、PbO、FeO、Fe2O3、MnO、MnO2、CdO等)为原料制备氧化锌的工艺流程如图所示:
②25℃时相关物质的Ksp如下表:
③ Zn(OH)2和ZnCO3的分解温度分别为125℃、300℃。
请回答下列问题:
(1)“氧化预处理”阶段得到的氧化产物有FeOOH、MnO2,写出生成FeOOH的离子方程式:___________ ;“氧化预处理”的目的是___________ 。
(2)若“氨浸”阶段溶解ZnO时消耗的n(NH3·H2O)∶n(NH4HCO3)=2∶1,写出该反应的离子方程式:___________ 。
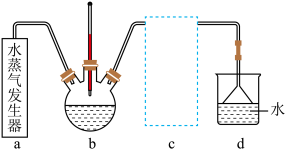
(3)实验室模拟蒸氨装置如图所示。蒸氨时控制温度为95℃左右,在装置b中[Zn(NH3)4]2+转化为碱式碳酸锌沉淀。___________ (填字母)。
A.液面上方但不接触液面 B.略伸入液面下 C.伸入溶液底部
②在不改变水蒸气的温度、浸出液用量和蒸氨时间的条件下,为提高蒸氨效率和锌的沉淀率,可采取的措施是___________ (写出一种)。
③混合气体e可返回至“___________ ”阶段循环利用。
(4)研究发现Znx(OH)y(CO3)z热分解得到ZnO的过程可分为两步。
某实验小组取11.2 g Znx(OH)y(CO3)z固体进行热重分析,两步反应的固体失重率( ×100%)依次为8.0%、19.6%,则Znx(OH)y(CO3)z的化学式为
×100%)依次为8.0%、19.6%,则Znx(OH)y(CO3)z的化学式为___________ 。
②25℃时相关物质的Ksp如下表:
| 物质 | MnS | FeS | ZnS | PbS | CdS | CuS |
| Ksp | 2.5×10-13 | 6.3×10-18 | 1.6×10-24 | 8.0×10-28 | 3.6×10-29 | 5.0×10-36 |
请回答下列问题:
(1)“氧化预处理”阶段得到的氧化产物有FeOOH、MnO2,写出生成FeOOH的离子方程式:
(2)若“氨浸”阶段溶解ZnO时消耗的n(NH3·H2O)∶n(NH4HCO3)=2∶1,写出该反应的离子方程式:
(3)实验室模拟蒸氨装置如图所示。蒸氨时控制温度为95℃左右,在装置b中[Zn(NH3)4]2+转化为碱式碳酸锌沉淀。
A.液面上方但不接触液面 B.略伸入液面下 C.伸入溶液底部
②在不改变水蒸气的温度、浸出液用量和蒸氨时间的条件下,为提高蒸氨效率和锌的沉淀率,可采取的措施是
③混合气体e可返回至“
(4)研究发现Znx(OH)y(CO3)z热分解得到ZnO的过程可分为两步。
某实验小组取11.2 g Znx(OH)y(CO3)z固体进行热重分析,两步反应的固体失重率(
氧化锌在橡胶、油漆涂料、化工、医疗及食品等行业有着广泛应用。一种以含锌烟灰(含有ZnO、CuO、PbO、FeO、Fe2O3、MnO、MnO2、CdO等)为原料制备氧化锌的工艺流程如图所示:
ii.25°C时相关物质的Ksp如下表:
iii.Zn(OH)2和ZnCO3的分解温度分别为125°C、300°C。
请回答下列问题:
(1)“氧化预处理”阶段得到的氧化产物有FeOOH、MnO2,写出生成FeOOH的离子方程式:___________ ;“氧化预处理”的目的是___________ 。
(2)若“氨浸”阶段溶解ZnO时消耗的n(NH3·H2O):n(NH4HCO3)=2:1,写出该反应的离子方程式:___________ 。
(3)已知:4NH3(aq)+Cu2+(aq)=[Cu(NH3)4]2+(aq) K=1013,则[Cu(NH3)4]2+(aq)+S2-(aq)=CuS(s)+4NH3(aq)的化学平衡常数K1为___________ 。
(4)实验室模拟蒸氨装置如图所示。蒸氨时控制温度为95°C左右,在装置b中[Zn(NH3)4]2+转化为碱式碳酸锌沉淀。___________ (填字母)。
A.液面上方但不接触液面
B.略伸入液面下
C.伸入溶液底部
②在不改变水蒸气的温度、浸出液用量和蒸氨时间的条件下,为提高蒸氨效率和锌的沉淀率,可采取的措施是___________ (写出一种)。
③混合气体e可返回至“___________ ”阶段循环利用。
(5)研究发现Znx(OH)y(CO3)z。热分解得到ZnO的过程可分为两步。某实验小组取11.2gZnx(OH)y(CO3)z固体进行热重分析,两步反应的固体失重率( )依次为8.0%、19.6%,则Znx(OH)y(CO3)z的化学式为
)依次为8.0%、19.6%,则Znx(OH)y(CO3)z的化学式为___________ 。
ii.25°C时相关物质的Ksp如下表:
| 物质 | MnS | FeS | ZnS | PbS | CdS | CuS |
| Ksp | 2.5×10-13 | 6.3×10-18 | 1.6×10-24 | 8.0×10-28 | 3.6×10-29 | 5.0×10-36 |
请回答下列问题:
(1)“氧化预处理”阶段得到的氧化产物有FeOOH、MnO2,写出生成FeOOH的离子方程式:
(2)若“氨浸”阶段溶解ZnO时消耗的n(NH3·H2O):n(NH4HCO3)=2:1,写出该反应的离子方程式:
(3)已知:4NH3(aq)+Cu2+(aq)=[Cu(NH3)4]2+(aq) K=1013,则[Cu(NH3)4]2+(aq)+S2-(aq)=CuS(s)+4NH3(aq)的化学平衡常数K1为
(4)实验室模拟蒸氨装置如图所示。蒸氨时控制温度为95°C左右,在装置b中[Zn(NH3)4]2+转化为碱式碳酸锌沉淀。
A.液面上方但不接触液面
B.略伸入液面下
C.伸入溶液底部
②在不改变水蒸气的温度、浸出液用量和蒸氨时间的条件下,为提高蒸氨效率和锌的沉淀率,可采取的措施是
③混合气体e可返回至“
(5)研究发现Znx(OH)y(CO3)z。热分解得到ZnO的过程可分为两步。某实验小组取11.2gZnx(OH)y(CO3)z固体进行热重分析,两步反应的固体失重率(
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网




