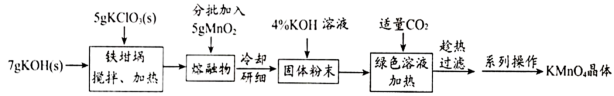
解答题-工业流程题 适中0.65 引用1 组卷117
已知:

回答下列问题:
(1)
(2)将固体研细并加入
(3)向绿色溶液中通入适量
A. | B. |
C.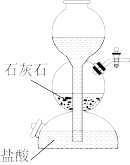 | D. |
(5)探究小组按如图所示过程探究
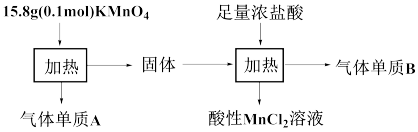
①若
②加入浓盐酸并加热时消耗溶质
21-22高三上·山东菏泽·期中
类题推荐
实验小组同学欲探究SO2的性质并测定空气中SO2的体积分数。他们设计了如图所示的实验装置,请你参与探究并回答问题。
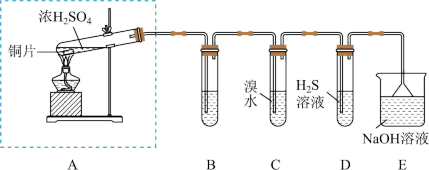
(1)装置A中发生反应的化学方程式为_______ 。
(2)装置E的作用是_______ 。
(3)装置B用于检验SO2的漂白性,其中所盛试剂为_______ ; 装置D用于验证SO2的_______ 性。
(4)装置C中的现象是_______ ;若将等物质的量SO2与Cl2通入紫色石蕊溶液,现象为_______ 。
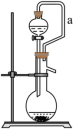
(5)如果用硫酸溶液和 Na2SO3固体反应制取 SO2装置如图所示。其中a导管的作用是_______ ;所用硫酸为70%浓硫酸,不用稀硫酸的原因是_______ 。
(6)拟用以下方案测定空气中SO2含量(假设空气中无其他还原性气体)。
空气 溶液
溶液
 固体mg
固体mg
实验中若通过空气的体积为33.6L(标准状况下),最终所得固体质量为0.233g,通过计算确定该空气中二氧化硫的含量是_______ 。(结果精确到0.001%)
(7)下列说法正确的是
(8)将一块锌片投入到100mL18.5mol·L-1 浓H2SO4 中,使之充分反应,观察到锌片完全溶解,同时生成气体33.6L(标准状况下)。将反应后的溶液稀释至1L,测得溶液中c(H+)为0.1mol·L-1,求:消耗的锌的质量_______ ;气体A的成分以及含量_______ 。

(1)装置A中发生反应的化学方程式为
(2)装置E的作用是
(3)装置B用于检验SO2的漂白性,其中所盛试剂为
(4)装置C中的现象是
(5)如果用硫酸溶液和 Na2SO3固体反应制取 SO2装置如图所示。其中a导管的作用是

(6)拟用以下方案测定空气中SO2含量(假设空气中无其他还原性气体)。
空气
实验中若通过空气的体积为33.6L(标准状况下),最终所得固体质量为0.233g,通过计算确定该空气中二氧化硫的含量是
(7)下列说法正确的是
| A.向某无色溶液滴加氯水后,再加入 CCl4,下层呈紫红色,则原溶液中一定存在I- |
| B.向某食盐溶液中滴加淀粉溶液,溶液颜色不变,则食盐中一定无添加碘酸钾 |
| C.灼烧白色粉末,火焰呈黄色,证明原粉末中一定含 Na+,无K+ |
| D.加入稀盐酸酸化的BaCl2 溶液,出现白色沉淀,则溶液中一定含有SO |
保险粉(连二亚硫酸钠, )常作漂白剂。目前工业上主要采用甲酸钠
)常作漂白剂。目前工业上主要采用甲酸钠 法制备保险粉。某小组在实验室制备保险粉并探究其性质。
法制备保险粉。某小组在实验室制备保险粉并探究其性质。
实验(一)制备保险粉。
反应原理为 ,装置如图所示(部分装置已省略)。
,装置如图所示(部分装置已省略)。
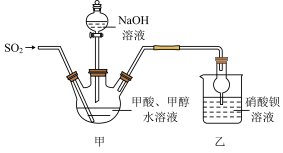
请回答下列问题:
(1)乙装置中产生的白色沉淀是___________ (填化学式)。
(2)实验中,先旋开分液漏斗的活塞,后通入 ,这样操作的目的是
,这样操作的目的是___________ 。若甲装置中不加入甲醇,则保险粉的产率将___________ (填“增大”“减小”或“不变”)。
(3)分离产品之前,需加入适量 粉末,其作用是
粉末,其作用是___________ 。
实验(二)探究保险粉的性质。
(4)由实验II可知,在该反应中 表现出的性质是
表现出的性质是___________ (填字母标号)。
A.氧化性 B.还原性 C.氧化性和还原性
写出实验III的离子方程式___________ 。
实验(三)测定保险粉的纯度。
(5)称取 连二亚硫酸钠样品溶于水配制成
连二亚硫酸钠样品溶于水配制成 溶液,准确量取
溶液,准确量取 配制溶液于锥形瓶中,加入足量甲醛溶液,充分反应后,滴加几滴淀粉溶液,用
配制溶液于锥形瓶中,加入足量甲醛溶液,充分反应后,滴加几滴淀粉溶液,用 碘水滴定至终点时消耗滴定液为
碘水滴定至终点时消耗滴定液为 。有关反应如下:
。有关反应如下:


滴定终点的现象是________ 。该 样品的纯度为
样品的纯度为________  (用含字母的式子表示)。
(用含字母的式子表示)。
实验(一)制备保险粉。
反应原理为

请回答下列问题:
(1)乙装置中产生的白色沉淀是
(2)实验中,先旋开分液漏斗的活塞,后通入
(3)分离产品之前,需加入适量
实验(二)探究保险粉的性质。
| 实验 | 操作及现象 |
| I | 取少量产品加热,将气体通入品红溶液中,品红溶液褪色 |
| II | 少量产品加入稀硫酸,产生气体,溶液变浑浊。将气体通入品红溶液,溶液褪色 |
| III | 向酸性 |
A.氧化性 B.还原性 C.氧化性和还原性
写出实验III的离子方程式
实验(三)测定保险粉的纯度。
(5)称取
滴定终点的现象是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网