解答题-原理综合题 适中0.65 引用1 组卷79
完成下列问题。
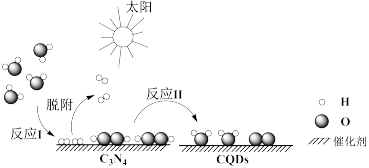
(1)中国化学家研究出一种新型复合光催化剂(C3N4/CQDs),能利用太阳光高效分解水,原理如下图所示。
已知化学键键能如下表:
①反应I化学方程式为___________ 。
②写出反应II的热化学方程式___________ 。
③设总反应反应热为∆H,反应I反应热为∆H1,则∆H___________ ∆H1填“>”“<”或“=”)。
(2)已知H3PO2(次磷酸)酸性比H3PO4弱,H3PO2与过量的NaOH反应生成NaH2PO2。
①写出次磷酸的电离方程式___________ 。
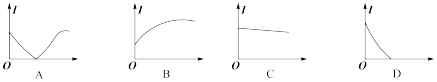
②向H3PO2溶液中逐滴加入等浓度的NaOH溶液至过量,其导电性变化图象为___________ ;向稀NaOH溶液中逐滴滴加浓H3PO2溶液至恰好中和,其导电性变化图象为___________ 。
③常温下磷酸和氢氧化钠溶液反应获得含磷各物种的分布分数与pH的关系如图所示。

由图分析:H3PO4的Ka1=___________ 。
(1)中国化学家研究出一种新型复合光催化剂(C3N4/CQDs),能利用太阳光高效分解水,原理如下图所示。

已知化学键键能如下表:
| 共价键 | O-H | O-O | O=O |
| 键能/(kJ∙mol-1) | 464 | 146 | 498 |
①反应I化学方程式为
②写出反应II的热化学方程式
③设总反应反应热为∆H,反应I反应热为∆H1,则∆H
(2)已知H3PO2(次磷酸)酸性比H3PO4弱,H3PO2与过量的NaOH反应生成NaH2PO2。
①写出次磷酸的电离方程式
②向H3PO2溶液中逐滴加入等浓度的NaOH溶液至过量,其导电性变化图象为

③常温下磷酸和氢氧化钠溶液反应获得含磷各物种的分布分数与pH的关系如图所示。

由图分析:H3PO4的Ka1=
21-22高二上·福建龙岩·期中
类题推荐
减弱温室效应的方法之一是将CO2回收利用,科学家研究利用回收的CO2制取甲醛,反应的热化学方程式为CO2(g)+2H2(g)⇌CH2O(g)+H2O(g) ∆H。请回答下列问题:
(1)已知:
①CH2O(g)+O2(g)=CO2(g)+H2O(g) ∆H1=-480kJ/mol
②2H2(g)+O2(g)=2H2O(g) ∆H2
相关化学键的键能数据如表所示:
则CO2(g)+2H2(g)⇌CH2O(g)+H2O(g)∆H=______ 。
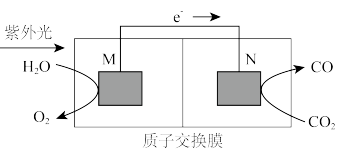
(2)利用如图所示装置可以将CO2转化为气体燃料CO(电解质溶液为稀硫酸),该装置工作时,M为____ 极(填“正”或“负”),导线中通过2mol电子后,假定体积不变,M极电解质溶液的pH______ (填“增大”、“减小”或“不变”),N极电解质溶液质量的变化m( ) g。
(3)已知H3PO2(次磷酸)与足量的NaOH反应只生成一种盐NaH2PO2。H3PO2水溶液中存在H3PO2分子。H3PO2易被氧化为H3PO4磷酸。
①写出次磷酸的电离方程式_______ 。
②常温下,NaH2PO2溶液的pH______ 。
A.>7 B.<7 C.=7 D.不能确定
(1)已知:
①CH2O(g)+O2(g)=CO2(g)+H2O(g) ∆H1=-480kJ/mol
②2H2(g)+O2(g)=2H2O(g) ∆H2
相关化学键的键能数据如表所示:
| 化学键 | O=O | H-H | O-H |
| 键能/kJ∙mol-1 | 498 | 436 | 464 |
(2)利用如图所示装置可以将CO2转化为气体燃料CO(电解质溶液为稀硫酸),该装置工作时,M为

(3)已知H3PO2(次磷酸)与足量的NaOH反应只生成一种盐NaH2PO2。H3PO2水溶液中存在H3PO2分子。H3PO2易被氧化为H3PO4磷酸。
①写出次磷酸的电离方程式
②常温下,NaH2PO2溶液的pH
A.>7 B.<7 C.=7 D.不能确定
Ⅰ.请回答下列问题:
(1)向冰醋酸中逐滴加水,溶液导电性随加入水的体积变化如下图所示:
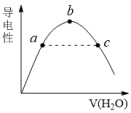
a、b、c三点溶液中CH3COOH的电离程度由大到小的顺序是___________ 。
(2)已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
①物质的量浓度均为0.1 mol/L的四种溶液:pH由小到大排列的顺序是___________ (用编号填写)
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
②写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:___________ 。
(3)已知常温时,a mol/L醋酸在水中与0.1 mol/L NaOH等体积混合,溶液为中性,则醋酸钠的水解平衡常数Kh=___________ (用含a的代数式表示)。
Ⅱ.结合下表回答下列问题(均为常温下的数据):
(4)0.1mol/L的H2C2O4溶液与0.1mol/L的KOH的溶液等体积混合后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为___________ 。
(5)pH相同的NaClO和CH3COOK溶液中,[c(Na+)-c(C1O-)]___________ [c(K+)-c(CH3COO-)](填“>”、“<”或“=”) 。
(6)向0.1mol/LCH3COOH 溶液中滴加NaOH 溶液至c(CH3COOH): c(CH3COO-)=5:9,此时溶液pH=___________ 。
(1)向冰醋酸中逐滴加水,溶液导电性随加入水的体积变化如下图所示:

a、b、c三点溶液中CH3COOH的电离程度由大到小的顺序是
(2)已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
②写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:
(3)已知常温时,a mol/L醋酸在水中与0.1 mol/L NaOH等体积混合,溶液为中性,则醋酸钠的水解平衡常数Kh=
Ⅱ.结合下表回答下列问题(均为常温下的数据):
| 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
| CH3COOH | 1.8×10-5 | H2CO3 | K1=4.4×10-7 | H2C2O4 | K1=5.4×10-2 | H2S | K1=1.3×10-7 |
| HClO | 3×10-8 | K2=4.7×10-11 | K2=5.4×10-5 | K2=7.1×10-15 |
(5)pH相同的NaClO和CH3COOK溶液中,[c(Na+)-c(C1O-)]
(6)向0.1mol/LCH3COOH 溶液中滴加NaOH 溶液至c(CH3COOH): c(CH3COO-)=5:9,此时溶液pH=
Ⅰ.请回答下列问题:
(1)向冰醋酸中逐滴加水,溶液导电性随加入水的体积变化如图所示:

a、b、c三点溶液中CH3COOH的电离程度由大到小的顺序是____ 。
(2)已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
①物质的量浓度均为0.1mol/L的四种溶液:pH由小到大排列的顺序是____ (用编号填写)。
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
②写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:____ 。
(3)已知常温时,amol/L醋酸在水中与0.1mol/LNaOH等体积混合,溶液为中性,则醋酸钠的水解平衡常数Kh=_____ (用含a的代数式表示)。
Ⅱ.结合表格回答下列问题(均为常温下的数据):
(4)0.1mol/L的KHC2O4溶液呈酸性,该溶液中各离子浓度由大到小的顺序为____ 。
(5)pH相同的NaClO和CH3COOK溶液中,[c(Na+)-c(C1O-)]____ [c(K+)-c(CH3COO-)](填“>”、“<”或“=”)。
(6)向0.1mol/LCH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5:9,此时溶液pH=____ 。(CH3COOH的电离平衡常数Ka=1.8×10-5)
(1)向冰醋酸中逐滴加水,溶液导电性随加入水的体积变化如图所示:

a、b、c三点溶液中CH3COOH的电离程度由大到小的顺序是
(2)已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
②写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:
(3)已知常温时,amol/L醋酸在水中与0.1mol/LNaOH等体积混合,溶液为中性,则醋酸钠的水解平衡常数Kh=
Ⅱ.结合表格回答下列问题(均为常温下的数据):
| 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
| CH3COOH | 1.8×10-5 | H2CO3 | K1=4.4×10-7 | H2C2O4 | K1=5.4×10-2 | H2S | K1=1.3×10-7 |
| HClO | 3×10-8 | K2=4.7×10-11 | K2=5.4×10-5 | K2=7.1×10-15 |
(5)pH相同的NaClO和CH3COOK溶液中,[c(Na+)-c(C1O-)]
(6)向0.1mol/LCH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5:9,此时溶液pH=
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


