解答题-原理综合题 适中0.65 引用1 组卷71
完成下列问题。
I.
(1)丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下:
①C4H10(g)=C4H8(g)+H2(g) ΔH1
②已知:②C4H10(g)+ O2(g)=C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
O2(g)=C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
③H2(g)+ O2(g)=H2O(g) ΔH3=-242 kJ·mol-1
O2(g)=H2O(g) ΔH3=-242 kJ·mol-1
反应①的ΔH1为___________ 。
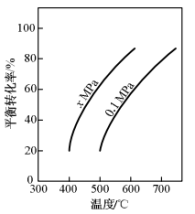
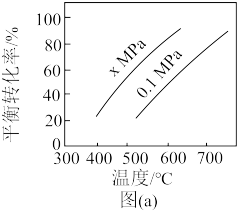
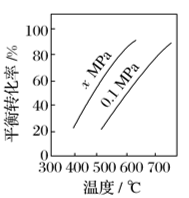
图(a)是反应①平衡转化率与反应温度及压强的关系图,x___________ (填“大于”或“小于”)0.1;欲使丁烯的平衡产率提高,应采取的措施是___________ (填标号)。
a.升高温度 B.降低温度 C.增大压强 D.降低压强
II.亚硝酰氯(NOCl)可由NO与Cl2反应得到,化学方程式为2NO(g)+Cl2(g)⇌2NOCl(g)。
(2)在一定温度下,该反应于一恒容密闭容器中达到平衡,继续通入Cl2,逆反应速率_______ (填“增大”“减小”或“不变”)。
(3)在10 L的恒容密闭容器中充入2 mol NO(g)和1 molCl2(g),在不同温度下测得c(NOCl)与时间的关系如下图:
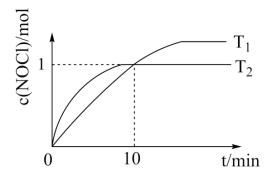
该反应的ΔH___________ (填“>”“<”或“=”)0,从反应开始到10 min时NO的平均反应速率v(NO)=______ 。T2时该反应的平衡常数K=_______ 。
I.
(1)丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下:
①C4H10(g)=C4H8(g)+H2(g) ΔH1
②已知:②C4H10(g)+
③H2(g)+
反应①的ΔH1为
图(a)是反应①平衡转化率与反应温度及压强的关系图,x
a.升高温度 B.降低温度 C.增大压强 D.降低压强

II.亚硝酰氯(NOCl)可由NO与Cl2反应得到,化学方程式为2NO(g)+Cl2(g)⇌2NOCl(g)。
(2)在一定温度下,该反应于一恒容密闭容器中达到平衡,继续通入Cl2,逆反应速率
(3)在10 L的恒容密闭容器中充入2 mol NO(g)和1 molCl2(g),在不同温度下测得c(NOCl)与时间的关系如下图:

该反应的ΔH
21-22高二上·福建龙岩·期中
类题推荐
I. 丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:正丁烷(C4H10)脱氢制
1-丁烯(C4H8)的热化学方程式如下:
①C4H10(g)=C4H8(g)+H2(g) ΔH1
已知:②C4H10(g)+ O2(g)=C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
O2(g)=C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
③H2(g)+ O2(g)=H2O(g) ΔH3=-242 kJ·mol-1
O2(g)=H2O(g) ΔH3=-242 kJ·mol-1
(1)反应①的ΔH1为________ kJ·mol-1。
(2)如图是反应①平衡转化率与反应温度及压强的关系图,x_____ (填“大于”或“小于”)0.1;
(3)欲使丁烯的平衡产率提高,应采取的措施是___(填标号)。
II.向一容积不变的密闭容器中充入一定量A和B,发生如下反应:xA(g)+2B(s) yC(g);△H<0。在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如下图。请回答下列问题:
yC(g);△H<0。在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如下图。请回答下列问题:
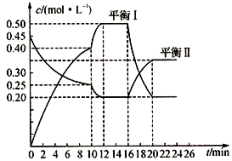
(4)用A的浓度变化表示该反应0~10min内的平均反应速率v(A)=_______ ;
(5)根据图示可确定x:y=______________ ;
(6)0~l0min容器内压强______________ (填“变大”,“不变”或“变小”)
(7)推测第l0min引起曲线变化的反应条件可能是___________ (填序号);第16 min引起曲线变化的反应条件可能是______________ (填序号);
①减压;②增大A的浓度;③增大C的量;④升温;⑤降温;⑥加催化剂
1-丁烯(C4H8)的热化学方程式如下:
①C4H10(g)=C4H8(g)+H2(g) ΔH1
已知:②C4H10(g)+
③H2(g)+
(1)反应①的ΔH1为
(2)如图是反应①平衡转化率与反应温度及压强的关系图,x

(3)欲使丁烯的平衡产率提高,应采取的措施是___(填标号)。
| A.升高温度 | B.降低温度 | C.增大压强 | D.降低压强 |
II.向一容积不变的密闭容器中充入一定量A和B,发生如下反应:xA(g)+2B(s)

(4)用A的浓度变化表示该反应0~10min内的平均反应速率v(A)=
(5)根据图示可确定x:y=
(6)0~l0min容器内压强
(7)推测第l0min引起曲线变化的反应条件可能是
①减压;②增大A的浓度;③增大C的量;④升温;⑤降温;⑥加催化剂
请回答下列问题。
I.1-丁烯是一种重要的化工原料,可由正丁烷催化脱氢制备。
(1)正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下:
①C4H10(g)=C4H8(g)+H2(g) △H1
②C4H10(g)+ O2(g)=C4H8(g)+H2O(g) △H2=-119kJ•mol-1
O2(g)=C4H8(g)+H2O(g) △H2=-119kJ•mol-1
③H2(g)+ O2(g)=H2O(g) △H3=-242kJ•mol-1
O2(g)=H2O(g) △H3=-242kJ•mol-1
反应①的△H1为______ kJ·mol-1。
(2)如图是反应①平衡转化率与反应温度及压强的关系图,x_____ 0.1(填“>”或“<”);欲使丁烯的平衡产率提高,应采取的措施是_____ 。
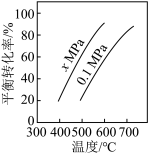
A.升高温度 B.降低温度 C.增大压强 D.降低压强
Ⅱ.煤化工是将煤经过化学加工转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(3)将不同物质的量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)=CO2(g)+H2(g),得到如表两组数据:
①实验1中以 (CO2)表示的化学反应速率为
(CO2)表示的化学反应速率为______ 。
②该反应的逆反应为______ (填“吸”或“放”)热反应。
(4)在一容积为2L的密闭容器内加入2molCO和6molH2,在一定条件下发生如下反应:CO(g)+2H2(g) CH3OH(g) △H<0。该反应的逆反应速率与时间的关系如图所示:
CH3OH(g) △H<0。该反应的逆反应速率与时间的关系如图所示:
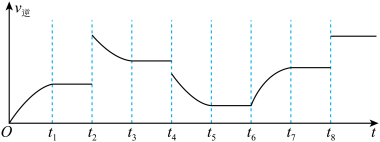
由图可知反应在有t1、t3、t5、t7时都达到了平衡,而在t2、t4、t6、t8时都改变了条件,改变的条件分别是t6:______ t8:______ 。
I.1-丁烯是一种重要的化工原料,可由正丁烷催化脱氢制备。
(1)正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下:
①C4H10(g)=C4H8(g)+H2(g) △H1
②C4H10(g)+
③H2(g)+
反应①的△H1为
(2)如图是反应①平衡转化率与反应温度及压强的关系图,x

A.升高温度 B.降低温度 C.增大压强 D.降低压强
Ⅱ.煤化工是将煤经过化学加工转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(3)将不同物质的量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)=CO2(g)+H2(g),得到如表两组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
①实验1中以
②该反应的逆反应为
(4)在一容积为2L的密闭容器内加入2molCO和6molH2,在一定条件下发生如下反应:CO(g)+2H2(g)

由图可知反应在有t1、t3、t5、t7时都达到了平衡,而在t2、t4、t6、t8时都改变了条件,改变的条件分别是t6:
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网