填空题 较易0.85 引用1 组卷83
CH3COONa溶液是常见的强碱弱酸盐溶液,可由醋酸和NaOH溶液反应得到。
(1)用离子方程式解释CH3COONa水溶液呈碱性的原因___________ 。
(2)用0.1000mol/L NaOH分别滴定25.00mL 0.1000mol/L盐酸和25.00mL 0.1000mol/L醋酸,滴定过程中pH变化曲线如下图所示。
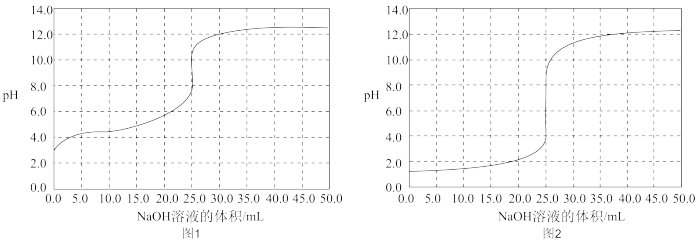
①在上述滴定过程中,不需要 使用的玻璃仪器是___________ (填序号)。
A.容量瓶 B.碱式滴定管 C.锥形瓶 D.胶头滴管
②由图中数据可判断滴定盐酸的pH变化曲线为图2,判断的理由如下(答出2点):
ⅰ.起始未滴加NaOH溶液时,___________ 。
ⅱ.___________ 。
③滴定CH3COOH溶液的过程中,当滴加12.50mL NaOH溶液时,溶液中各离子浓度由大到小的顺序是___________ (用符号“c”及“>”表示)。
(3)向0.1mol/LCH3COONa溶液中逐滴加入0.1mol/L盐酸至恰好反应。反应过程中,你认为CH3COONa的水解平衡向___________ (填“左”或“右”)移动,分析的过程:当滴入稀盐酸后,___________ 。
(1)用离子方程式解释CH3COONa水溶液呈碱性的原因
(2)用0.1000mol/L NaOH分别滴定25.00mL 0.1000mol/L盐酸和25.00mL 0.1000mol/L醋酸,滴定过程中pH变化曲线如下图所示。

①在上述滴定过程中,
A.容量瓶 B.碱式滴定管 C.锥形瓶 D.胶头滴管
②由图中数据可判断滴定盐酸的pH变化曲线为图2,判断的理由如下(答出2点):
ⅰ.起始未滴加NaOH溶液时,
ⅱ.
③滴定CH3COOH溶液的过程中,当滴加12.50mL NaOH溶液时,溶液中各离子浓度由大到小的顺序是
(3)向0.1mol/LCH3COONa溶液中逐滴加入0.1mol/L盐酸至恰好反应。反应过程中,你认为CH3COONa的水解平衡向
21-22高二上·北京昌平·期中
类题推荐  溶液是常见的强碱弱酸盐,可由醋酸和
溶液是常见的强碱弱酸盐,可由醋酸和 溶液反应得到。
溶液反应得到。
(1)用化学用语表示 溶液呈碱性的原因
溶液呈碱性的原因___________ (用离子方程式表示); 溶液呈电中性,请用等式表示这一现象
溶液呈电中性,请用等式表示这一现象___________ (用浓度符号“c”表示)
(2)用 分别滴定
分别滴定 盐酸和
盐酸和 醋酸,滴定过程中
醋酸,滴定过程中 变化曲线如图所示。
变化曲线如图所示。


①在上述滴定过程中,不需要 使用的玻璃仪器是___________ (填序号)。
A.容量瓶 B.碱式滴定管 C.锥形瓶 D.胶头滴管
②由图中数据判断滴定盐酸的 变化曲线为
变化曲线为___________ (填“图1”或“图2”),判断的理由:
ⅰ、起始未滴加 液时,
液时, 盐酸的
盐酸的
___________ 。
ⅱ、加入 溶液恰好反应时,所得
溶液恰好反应时,所得 溶液的
溶液的
___________ 。
③滴定 溶液的过程中,当滴加
溶液的过程中,当滴加 溶液时,溶液中各离子浓度由大到小的顺序是
溶液时,溶液中各离子浓度由大到小的顺序是___________ (用符号“c”及“>”表示),此时溶液中
___________ 。
(3)用 盐酸滴定
盐酸滴定 未知浓度的
未知浓度的 溶液。下列操作会使测定结果偏低的是___________。
溶液。下列操作会使测定结果偏低的是___________。
(1)用化学用语表示
(2)用


①在上述滴定过程中,
A.容量瓶 B.碱式滴定管 C.锥形瓶 D.胶头滴管
②由图中数据判断滴定盐酸的
ⅰ、起始未滴加
ⅱ、加入
③滴定
(3)用
| A.量取 |
| B.酸式滴定管未用标准盐酸润洗 |
| C.滴定过程中滴定管内不慎有标准液溅出 |
| D.滴定前俯视读数,滴定后读数正确 |
电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如表:
①0.1mol/LNaCN溶液和0.1mol/LCH3COONa溶液中,
______  (填“
(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。
②常温下,物质的量浓度相同的三种溶液:A. CH3COONa B. NaCN C. Na2CO3,其pH由大到小的顺序是______ (填编号)。
③将少量CO2通入NaCN溶液,反应的离子方程式是______ 。
④室温下,一定浓度的CH3COONa溶液pH=9,用离子方程式表示溶液呈碱性的原因是______ ,溶液中c(CH3COO-)/c(CH3COOH) =______ 。
(2)常温下,向20.00mL0.1000mol/L的醋酸溶液中逐滴加入0.1000mol/L的NaOH溶液,pH值随NaOH溶液体积的变化如图所示。

①d点(NaOH溶液为20mL时)所示的溶液中离子浓度由大到小的顺序依次为______ 。
②b点所示的溶液中c(CH3COO-)-c(CH3COOH)=______ (写表达式)。
(1)已知部分弱酸的电离常数如表:
| 弱酸 | |||
| 电离常数(25℃) |
②常温下,物质的量浓度相同的三种溶液:A. CH3COONa B. NaCN C. Na2CO3,其pH由大到小的顺序是
③将少量CO2通入NaCN溶液,反应的离子方程式是
④室温下,一定浓度的CH3COONa溶液pH=9,用离子方程式表示溶液呈碱性的原因是
(2)常温下,向20.00mL0.1000mol/L的醋酸溶液中逐滴加入0.1000mol/L的NaOH溶液,pH值随NaOH溶液体积的变化如图所示。

①d点(NaOH溶液为20mL时)所示的溶液中离子浓度由大到小的顺序依次为
②b点所示的溶液中c(CH3COO-)-c(CH3COOH)=
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网




