解答题-原理综合题 适中0.65 引用1 组卷67
电镀工业往往产生含CrO 、Cr2O
、Cr2O 的含铬废水,排放前须将二者还原为Cr3+,之后再沉淀出Cr(OH)3,经处理后的废水中铬含量显著降低。
的含铬废水,排放前须将二者还原为Cr3+,之后再沉淀出Cr(OH)3,经处理后的废水中铬含量显著降低。
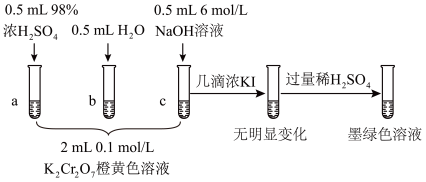
(1)化学平衡2CrO +2H+
+2H+ Cr2O
Cr2O +H2O K=4.2×1014。体系中c(H+)=0.01mol·L-1时,比较c(Cr2O
+H2O K=4.2×1014。体系中c(H+)=0.01mol·L-1时,比较c(Cr2O )、c(CrO
)、c(CrO )的大小:
)的大小:___________ 。
(2)化学还原法处理含铬废水
ⅰ.向废水中加入H2SO3(二元弱酸;SO2溶于水即得H2SO3)。
①H2SO3的电离平衡常数Ka1的表达式为___________ 。
②将Cr2O 转变为Cr3+,利用了H2SO3的酸性和
转变为Cr3+,利用了H2SO3的酸性和___________ 性。
ⅱ.投加生石灰,将Cr3+沉淀为Cr(OH)3。
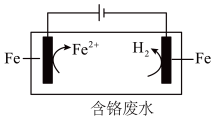
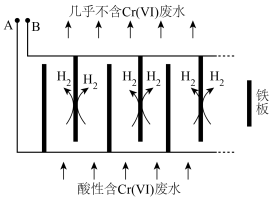
(3)电解还原法处理酸性含铬废水:以铁板做阴、阳极,电解含铬废水,示意如下。

①阳极产生的Fe2+将Cr2O 还原为Cr3+的离子方程式为:
还原为Cr3+的离子方程式为:___________ 。
②阴极区的pH___________ (填“增大”或“减小”),使Cr3+、Fe3+形成Cr(OH)3、Fe(OH)3沉淀。
③随着电解的进行,阳极铁板会发生钝化,表面形成FeO·Fe2O3的钝化膜,使电解池不能正常工作。将阴极铁板与阳极铁板交换使用,一段时间后,钝化膜消失。结合有关反应,解释钝化膜消失的原因:___________ 。
(1)化学平衡2CrO
(2)化学还原法处理含铬废水
ⅰ.向废水中加入H2SO3(二元弱酸;SO2溶于水即得H2SO3)。
①H2SO3的电离平衡常数Ka1的表达式为
②将Cr2O
ⅱ.投加生石灰,将Cr3+沉淀为Cr(OH)3。
(3)电解还原法处理酸性含铬废水:以铁板做阴、阳极,电解含铬废水,示意如下。

①阳极产生的Fe2+将Cr2O
②阴极区的pH
③随着电解的进行,阳极铁板会发生钝化,表面形成FeO·Fe2O3的钝化膜,使电解池不能正常工作。将阴极铁板与阳极铁板交换使用,一段时间后,钝化膜消失。结合有关反应,解释钝化膜消失的原因:
21-22高二上·北京昌平·期中
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
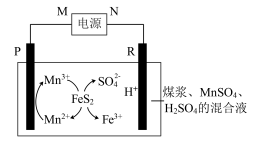
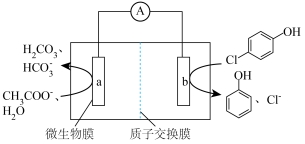
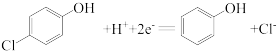 ,经处理后的水样中要求对氯苯酚的含量小于m mol/L。若废水中对氯苯酚的含量是n mol/L,则处理1 m3废水,至少添加CH3COO-的物质的量为
,经处理后的水样中要求对氯苯酚的含量小于m mol/L。若废水中对氯苯酚的含量是n mol/L,则处理1 m3废水,至少添加CH3COO-的物质的量为