解答题-原理综合题 适中0.65 引用1 组卷275
二氧化碳的一种资源化利用发生的反应有:
反应I:CO2(g)+4H2(g)=CH4(g)+2H2O(g) ∆H1<0
反应II:CO2(g)+H2(g)=CO(g)+H2O(g) ∆H2=+41.2kJ•mol-1
(1)若已知H2和CH4的燃烧热分别为akJ•mol-1、bkJ•mol-1,水的汽化热为ckJ•mol-1,则∆H1=__ kJ•mol-1。(注:以含a、b、c的代数式表示)
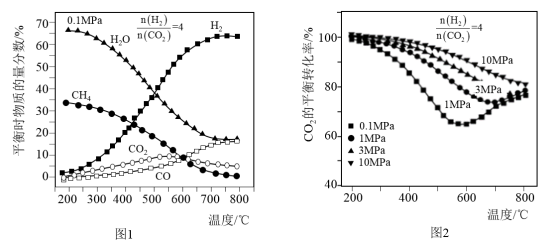
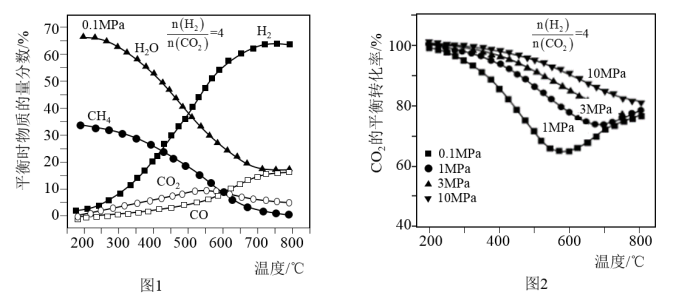
(2)按n(CO2):n(H2)=1:4的混合气体充入密闭容器中发生上述反应,当不同压强时,CO2的平衡转化率如图甲所示;气体总压强为0.1MPa时,平衡时各物质的物质的量分数如图乙所示:
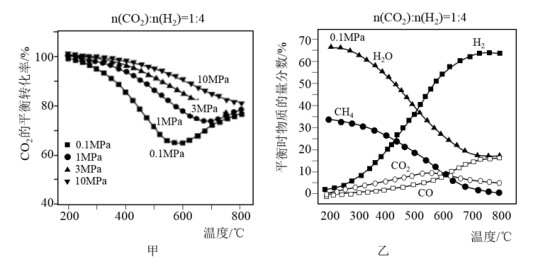
①0.1MPa时,CO2的转化率在600℃之后,随温度升高而增大的主要原因是__ 。
②据图示可知,密闭容器中的温度最好为__ 。
③在一定温度条件下,为了提高CO2的平衡转化率,可以采取的措施有__ 。(任意合理的两条)
(3)二氧化碳的资源化利用反应III为CO2(g)+3H2(g) CH3OH(g)+H2O(g) ∆H3=-49kJ•mol-1。
CH3OH(g)+H2O(g) ∆H3=-49kJ•mol-1。
①反应III的△S__ (填“>”或“<")0。
②在初始压强为P0的某恒温、恒容密闭容器中,按n(CO2):n(H2)=1:3投料比进行反应III,达到平衡时测得体系中CO2的物质的量分数为 ,则H2的平衡转化率α=
,则H2的平衡转化率α=__ %,该温度下反应平衡常数KP为__ (用含P0的表达式表示,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
反应I:CO2(g)+4H2(g)=CH4(g)+2H2O(g) ∆H1<0
反应II:CO2(g)+H2(g)=CO(g)+H2O(g) ∆H2=+41.2kJ•mol-1
(1)若已知H2和CH4的燃烧热分别为akJ•mol-1、bkJ•mol-1,水的汽化热为ckJ•mol-1,则∆H1=
(2)按n(CO2):n(H2)=1:4的混合气体充入密闭容器中发生上述反应,当不同压强时,CO2的平衡转化率如图甲所示;气体总压强为0.1MPa时,平衡时各物质的物质的量分数如图乙所示:

①0.1MPa时,CO2的转化率在600℃之后,随温度升高而增大的主要原因是
②据图示可知,密闭容器中的温度最好为
③在一定温度条件下,为了提高CO2的平衡转化率,可以采取的措施有
(3)二氧化碳的资源化利用反应III为CO2(g)+3H2(g)
①反应III的△S
②在初始压强为P0的某恒温、恒容密闭容器中,按n(CO2):n(H2)=1:3投料比进行反应III,达到平衡时测得体系中CO2的物质的量分数为
21-22高三上·云南昆明·阶段练习
类题推荐
CCUS是一种碳捕获、利用与封存的技术,这种技术可将CO2资源化,产生经济效益。请回答下列问题:
(1)以废气中的CO2为原料可制取甲醇。在恒容密闭容器中,298K和101kPa下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
①已知:H2(g)、CH3OH(l)的燃烧热 H分别为-285.8kJ/mol和-726.5kJ/mol;
H分别为-285.8kJ/mol和-726.5kJ/mol;
CH3OH(l)= CH3OH(g) H=+38kJ/mol;H2O(l)=H2O(g)
H=+38kJ/mol;H2O(l)=H2O(g) H=+44kJ/mol;
H=+44kJ/mol;
则CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g) H=
H=______ kJ/mol。
②若T0℃时,在密闭容器中加入6molH2、4molCO2进行反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),维持压强为p0不变,达到平衡时H2的转化率是50%,则该温度下反应的平衡常数Kp=
CH3OH(g)+H2O(g),维持压强为p0不变,达到平衡时H2的转化率是50%,则该温度下反应的平衡常数Kp=_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③起始温度、容器体积相同(T1℃、2L密闭容器),一定条件下,反应I、II起始CO2、H2、CH3OH(g)、H2O(g)的物质的量如表所示:
对比反应I、II平衡常数:K(I)_______ (填“>”“<"或“=”,下同)K(II);平衡时CH3OH的浓度:c(I)______ c(II)。
(2)CO2可用来合成低碳烯烃:2CO2(g)+6H2(g) CH2=CH2(g)+4H2O(g)
CH2=CH2(g)+4H2O(g) H=-127.8kJ/mol;在0.1MPa下,CO2和H2以n(CO2):n(H2)=1:3的投料比充入体积固定的密闭容器中,发生上述反应,不同温度下,反应达到平衡时的四种气态物质的物质的量分数如图所示:
H=-127.8kJ/mol;在0.1MPa下,CO2和H2以n(CO2):n(H2)=1:3的投料比充入体积固定的密闭容器中,发生上述反应,不同温度下,反应达到平衡时的四种气态物质的物质的量分数如图所示:
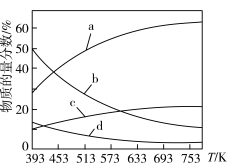
①曲线b、c表示的物质分别为_____ (填化学式)。
②保持某一温度不变,在体积为VL的恒容容器中以n(CO2):n(H2)=2:3的投料比加入反应物,达到化学平衡后,将容器体积瞬间扩大至2VL并保持不变,重新达到新的平衡。则在整个过程中混合气体的平均相对分子质量 随时间变化为:
随时间变化为:_______ 。
(1)以废气中的CO2为原料可制取甲醇。在恒容密闭容器中,298K和101kPa下发生反应:CO2(g)+3H2(g)
①已知:H2(g)、CH3OH(l)的燃烧热
CH3OH(l)= CH3OH(g)
则CO2(g)+3H2(g)
②若T0℃时,在密闭容器中加入6molH2、4molCO2进行反应:CO2(g)+3H2(g)
③起始温度、容器体积相同(T1℃、2L密闭容器),一定条件下,反应I、II起始CO2、H2、CH3OH(g)、H2O(g)的物质的量如表所示:
| n(CO2)/mol | n(H2)/mol | n[CH3OH(g)]/mol | n[H2O(g)]/mol | |
| 反应Ⅰ | 2 | 6 | 0 | 0 |
| 反应Ⅱ | 0 | 0 | 2 | 2 |
(2)CO2可用来合成低碳烯烃:2CO2(g)+6H2(g)

①曲线b、c表示的物质分别为
②保持某一温度不变,在体积为VL的恒容容器中以n(CO2):n(H2)=2:3的投料比加入反应物,达到化学平衡后,将容器体积瞬间扩大至2VL并保持不变,重新达到新的平衡。则在整个过程中混合气体的平均相对分子质量
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网