填空题 适中0.65 引用2 组卷360
全球气候变化对全球人类社会构成重大威胁。政府气候变化专门委员会(IPCC)报告认为,为了避免极端危害,世界必须将全球变暖幅度控制在1.5℃以内。只有全球都在21世纪中叶实现温室气体净零排放,才能有可能实现这一目标。请根据二氧化碳的利用回答下列问题:
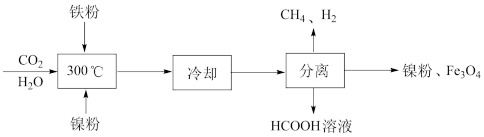
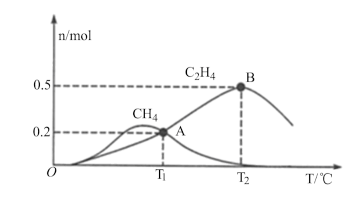
(1)CO2催化氢化制甲烷的研究过程如图1:
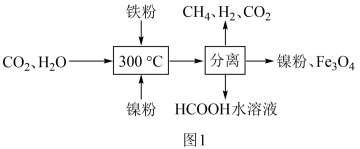
①上述过程中,加入铁粉的作用是__ 。
②HCOOH是CO2转化为CH4的中间体:CO2 HCOOH
HCOOH CH4。当镍粉用量增加10倍后,甲酸的产量迅速减少,原因是
CH4。当镍粉用量增加10倍后,甲酸的产量迅速减少,原因是__ 。
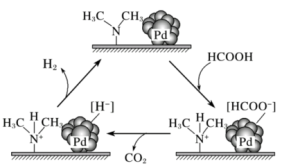
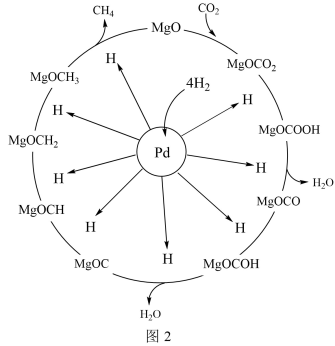
(2)一定条件下,Pd—Mg/SiO2催化剂可使CO2甲烷化从而变废为宝,其反应机理如图2所示,该反应的化学方程式为__ 。
(3)CO2加氢还可制备甲酸(HCOOH)。
①温度为T1℃时,将等物质的量的CO2和H2充入体积为1L的密闭容器中发生反应:CO2(g)+H2(g) HCOOH(g) △H=-31.4kJ•mol-1 K=0.8。实验测得:v正=k正c(CO2)•c(H2),v逆=k逆c(HCOOH),k正、k逆为速率常数。T1℃时,k逆=
HCOOH(g) △H=-31.4kJ•mol-1 K=0.8。实验测得:v正=k正c(CO2)•c(H2),v逆=k逆c(HCOOH),k正、k逆为速率常数。T1℃时,k逆=__ k正。
②温度为T2℃时,k正=1.1k逆,则T2℃时平衡压强__ (填“>”“<”或“=”)T1℃时平衡压强。
(4)N—甲基二乙醇胺(用MDEA表示)水溶液具有吸收能力强、对设备腐蚀小等特点,MDEA吸收CO2的反应可以表示为:MDEA(aq)+CO2(g)+H2O(l) MDEAH+(aq)+HCO
MDEAH+(aq)+HCO (aq) △H。
(aq) △H。
①已知MDEA中的氮具有一元碱(类似于NH3)的性质,Kb=5.2×10-4,已知H2CO3的Ka1=4.3×10-7,Ka2=5.6×10-11,推测溶液MDEAHHCO3显__ 性(填酸,碱,中)。
②标准平衡常数Kθ可以表示平衡时各物质的浓度关系:如反应A(aq)+2B(g) C(g)+D(aq)的Kθ=
C(g)+D(aq)的Kθ= ,其中cθ=2mol/L,pθ为标准大气压,p(B)、p(C)分别为气体的分压,c为物质的量浓度,T℃时,在刚性密闭容器中有20L2.5mol/L的MDEA溶液,氮气(不参加反应)和二氧化碳混合气体14mol,起始气体总压为pθkPa,充分吸收后,MDEA浓度降低为20L2.2mol/L,二氧化碳的吸收率为60%,忽略反应过程中溶液的体积变化,则反应的标准平衡常数Kθ=
,其中cθ=2mol/L,pθ为标准大气压,p(B)、p(C)分别为气体的分压,c为物质的量浓度,T℃时,在刚性密闭容器中有20L2.5mol/L的MDEA溶液,氮气(不参加反应)和二氧化碳混合气体14mol,起始气体总压为pθkPa,充分吸收后,MDEA浓度降低为20L2.2mol/L,二氧化碳的吸收率为60%,忽略反应过程中溶液的体积变化,则反应的标准平衡常数Kθ=__ (计算结果保留两位小数)。
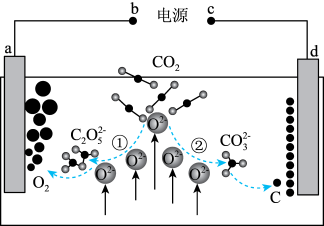
(5)设计二氧化碳熔盐捕获及电化学转化装置示意图如图:
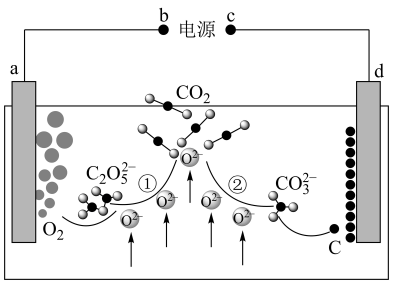
a极的电极反应式为__ 。
(1)CO2催化氢化制甲烷的研究过程如图1:

①上述过程中,加入铁粉的作用是
②HCOOH是CO2转化为CH4的中间体:CO2
(2)一定条件下,Pd—Mg/SiO2催化剂可使CO2甲烷化从而变废为宝,其反应机理如图2所示,该反应的化学方程式为

(3)CO2加氢还可制备甲酸(HCOOH)。
①温度为T1℃时,将等物质的量的CO2和H2充入体积为1L的密闭容器中发生反应:CO2(g)+H2(g)
②温度为T2℃时,k正=1.1k逆,则T2℃时平衡压强
(4)N—甲基二乙醇胺(用MDEA表示)水溶液具有吸收能力强、对设备腐蚀小等特点,MDEA吸收CO2的反应可以表示为:MDEA(aq)+CO2(g)+H2O(l)
①已知MDEA中的氮具有一元碱(类似于NH3)的性质,Kb=5.2×10-4,已知H2CO3的Ka1=4.3×10-7,Ka2=5.6×10-11,推测溶液MDEAHHCO3显
②标准平衡常数Kθ可以表示平衡时各物质的浓度关系:如反应A(aq)+2B(g)
(5)设计二氧化碳熔盐捕获及电化学转化装置示意图如图:

a极的电极反应式为
21-22高三上·辽宁铁岭·阶段练习
类题推荐
煤炭燃烧时产生大量SO2、NO对环境造成很大污染,将煤进行气化和液化是减少污染的有效手段。
(1)煤的液化是现代能源工业中重点推广的能源综合利用方案,最常见的液化方法为用煤生产CH3OH。已知制备甲醇的有关化学反应及平衡常数如下:
i:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1
CH3OH(g)+H2O(g) △H1
ii:CO2(g)+H2(g) CO(g)+H2O(g) △H2=41.2kJ/mol
CO(g)+H2O(g) △H2=41.2kJ/mol
iii:CO(g)+2H2(g) CH3OH(g) △H3=-132.0kJ/mol
CH3OH(g) △H3=-132.0kJ/mol
850℃时,三个反应的平衡常数分别为K1=160、K2=243、K3=160。
①△H1=____ ,该反应在____ (填“高温”或“低温”)能自发进行。
②850℃时,在密闭容器中进行反应i,开始时只加入CO2、H2,反应10min后测得各组分的浓度如表。比较正、逆反应的速率的大小:v正____ v逆(填“>”“<”或“=”)。
(2)在CO2利用的科研中,中科院天津工业生物所将H2与CO2反应合成甲醇,再由甲醇经若干酶促反应合成淀粉,首次在实验室实现二氧化碳到淀粉的从头合成。该研究成果在碳中和、碳排放、温室效应、粮食危机等方面有着重大意义。
回答下列问题:
保持温度T不变,在一刚性密闭容器中,充入一定量的CO2和H2,同时发生反应i和ii,起始及达平衡时,容器内各气体的物质的量如表所示。
已知起始时总压强为1.5pkPa,平衡时体系总压强为pkPa,则表中n1=____ ,反应i的平衡常数Kp=____ 。(含p的式子表示)
(3)取物质的量浓度为amol•L-1的甲醇,选择不同的工程酶组块作为催化剂反应10h,测得实验数据如表所示。
①根据表中数据选取最佳的反应条件____ (填实验序号)。
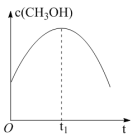
②已知温度升高,反应生成的淀粉量先增加后急剧减少,其可能原因是____ 。
③实验4可用淀粉的质量浓度表示反应速率为____ g•L-1•h-1。
(1)煤的液化是现代能源工业中重点推广的能源综合利用方案,最常见的液化方法为用煤生产CH3OH。已知制备甲醇的有关化学反应及平衡常数如下:
i:CO2(g)+3H2(g)
ii:CO2(g)+H2(g)
iii:CO(g)+2H2(g)
850℃时,三个反应的平衡常数分别为K1=160、K2=243、K3=160。
①△H1=
②850℃时,在密闭容器中进行反应i,开始时只加入CO2、H2,反应10min后测得各组分的浓度如表。比较正、逆反应的速率的大小:v正
| 物质 | H2 | CO2 | CH3OH | H2O |
| 浓度/mol/L | 0.2 | 0.5 | 0.8 | 0.8 |
回答下列问题:
保持温度T不变,在一刚性密闭容器中,充入一定量的CO2和H2,同时发生反应i和ii,起始及达平衡时,容器内各气体的物质的量如表所示。
| CO2 | H2 | CH3OH | CO | H2O | |
| 起始量/mol | 4.0 | 8.0 | 0 | 0 | 0 |
| 平衡量/mol | n1 | 3.0 |
(3)取物质的量浓度为amol•L-1的甲醇,选择不同的工程酶组块作为催化剂反应10h,测得实验数据如表所示。
| 实验序号 | 温度/K | 不同工程酶的组块 | 淀粉/(g•L-1) |
| 1 | T1 | agp-M1 | 0.21 |
| 2 | T1 | agp-M2 | 0.38 |
| 3 | T2 | agp-M2 | 1.82 |
| 4 | T2 | agp-M3 | 1.24 |
②已知温度升高,反应生成的淀粉量先增加后急剧减少,其可能原因是
③实验4可用淀粉的质量浓度表示反应速率为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网