解答题-原理综合题 适中0.65 引用1 组卷297
CH4‒CO2催化重整对温室气体的减排具有重要意义,其反应为:CH4(g)+CO2(g) 2CO(g)+2H2(g)。回答下列问题:
2CO(g)+2H2(g)。回答下列问题:
(1)已知相关物质的燃烧热(25℃、101kPa):
则CH4‒CO2催化重整反应的ΔH=___________ kJ·mol−1。
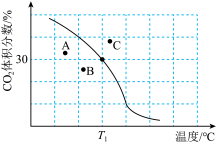
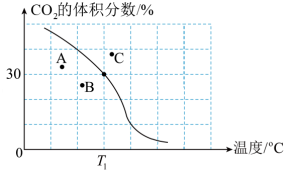
(2)将原料按初始组成n(CH4):n(CO2)=1:1充入密闭容器中,保持体系压强为100kPa发生反应,达到平衡时CO2体积分数与温度的关系如图所示。
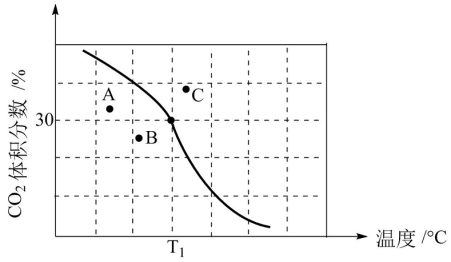
①T1℃、100kPa下,n(平衡时气体):n(初始气体)=___________ ;该温度下,此反应的平衡常数Kp=___________ (kPa)2(以分压表示,列出计算式)。
②若A、B、C三点表示不同温度和压强下已达平衡时CO2的体积分数,___________ 点对应的平衡常数最小,理由是___________ 。
(3)其它条件相同,在不同催化剂(A、B)作用下,反应CH4(g)+CO2(g) 2CO(g)+2H2(g)进行相同时间后,CO的产率随反应温度的变化如图:
2CO(g)+2H2(g)进行相同时间后,CO的产率随反应温度的变化如图:
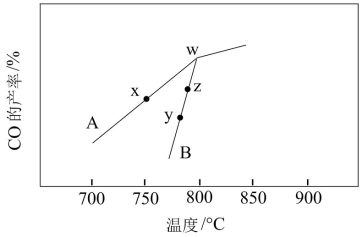
①在催化剂A、B作用下,它们正、逆反应活化能差值分别用E(A)、E(B)表示,则E(A)___________ E(B)(填“>”、“<”或“=”下同)。
②y点对应的 (逆)
(逆)___________ z点对应的 (正)。
(正)。
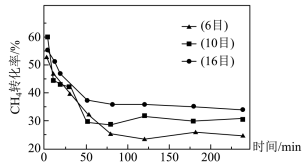
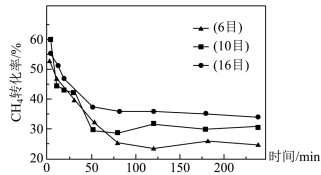
(4)900℃下,将CH4和CO2的混合气体(投料比1:1)按一定流速通过盛有炭催化剂的反应器,测得CH4的转化率受炭催化剂颗粒大小的影响如图所示。(注:目数越大,表示炭催化剂颗粒越小)。由图可知,75min后CH4转化率与炭催化剂目数的关系为___________ ,原因是___________ 。

(1)已知相关物质的燃烧热(25℃、101kPa):
| 物质 | CH4(g) | CO(g) | H2(g) |
| 燃烧热(ΔH/kJ·mol−1) | ‒890.3 | ‒283.0 | ‒285.8 |
则CH4‒CO2催化重整反应的ΔH=
(2)将原料按初始组成n(CH4):n(CO2)=1:1充入密闭容器中,保持体系压强为100kPa发生反应,达到平衡时CO2体积分数与温度的关系如图所示。

①T1℃、100kPa下,n(平衡时气体):n(初始气体)=
②若A、B、C三点表示不同温度和压强下已达平衡时CO2的体积分数,
(3)其它条件相同,在不同催化剂(A、B)作用下,反应CH4(g)+CO2(g)

①在催化剂A、B作用下,它们正、逆反应活化能差值分别用E(A)、E(B)表示,则E(A)
②y点对应的
(4)900℃下,将CH4和CO2的混合气体(投料比1:1)按一定流速通过盛有炭催化剂的反应器,测得CH4的转化率受炭催化剂颗粒大小的影响如图所示。(注:目数越大,表示炭催化剂颗粒越小)。由图可知,75min后CH4转化率与炭催化剂目数的关系为

21-22高三上·四川绵阳·阶段练习
类题推荐  和
和 的催化重整对温室气体的减排具有重要意义,其反应为:
的催化重整对温室气体的减排具有重要意义,其反应为:
 。回答下列问题:
。回答下列问题:
(1)已知相关物质的燃烧热(25℃、101kPa):
则 燃烧热
燃烧热
_____  。
。
(2)其他条件相同,在不同催化剂(A、B)作用下,反应 进行相同时间后,CO的产率随反应温度的变化如图所示。
进行相同时间后,CO的产率随反应温度的变化如图所示。
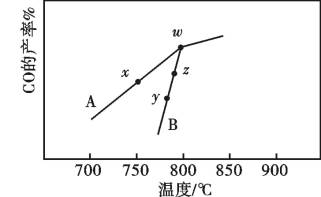
①由图可知,催化效果较好的催化剂是_____ ,在催化剂A、B作用下,它们反应活化能分别用 、
、 表示,则
表示,则
_____  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②w点_____ (填“能”或“不能”)表示上述反应达到平衡状态,理由是_____ 。
③速率大小比较:y点对应的
_____ z点对应的 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(3)将原料 和
和 按等物质的量充入密闭容器中,保持体系压强为100kPa发生反应:
按等物质的量充入密闭容器中,保持体系压强为100kPa发生反应:
 。达到平衡时,
。达到平衡时, 体积分数与温度的关系如图所示。
体积分数与温度的关系如图所示。
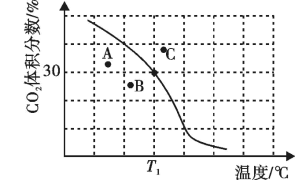
①若A、B、C三点表示不同温度和压强下达到平衡时 的体积分数,则
的体积分数,则_____ 点对应的平衡常数最小,理由是_____ 。
② 、100kPa下,达平衡时
、100kPa下,达平衡时 转化率=
转化率=_____ ;该温度下,此反应的平衡常数
_____  (以分压表示,分压=总压强×气体成分的物质的量分数)。
(以分压表示,分压=总压强×气体成分的物质的量分数)。
(1)已知相关物质的燃烧热(25℃、101kPa):
| 物质 | |||
| 燃烧热 | ? | -283.0 | -285.8 |
(2)其他条件相同,在不同催化剂(A、B)作用下,反应

①由图可知,催化效果较好的催化剂是
②w点
③速率大小比较:y点对应的
(3)将原料

①若A、B、C三点表示不同温度和压强下达到平衡时
②
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网