填空题 较易0.85 引用1 组卷112
氮的化合物在生产、生活中广泛存在。回答下列问题:
(1)用焦炭还原NO的反应为 ,向容积均为1L的甲、乙、丙三个恒容、恒温(反应温度分别为400℃、400℃、
,向容积均为1L的甲、乙、丙三个恒容、恒温(反应温度分别为400℃、400℃、 )容器中分别加入足量的焦炭和一定量的NO,测得各容器中
)容器中分别加入足量的焦炭和一定量的NO,测得各容器中 随反应时间
随反应时间 的变化情况如下表所示:
的变化情况如下表所示:
①该反应为___________ (填“放热”或“吸热”)反应,该反应的平衡常数的表达式为K=___________ 。
②乙容器在200min达到平衡状态,则0~200min内用NO的浓度变化表示的平均反应速率 =
=___________ 。
(2)用焦炭还原 的反应为
的反应为 。在恒温(
。在恒温( )条件下,1mol
)条件下,1mol 和足量的焦炭发生该反应,测得平衡时
和足量的焦炭发生该反应,测得平衡时 和
和 的物质的量浓度与平衡总压的关系如图所示。
的物质的量浓度与平衡总压的关系如图所示。
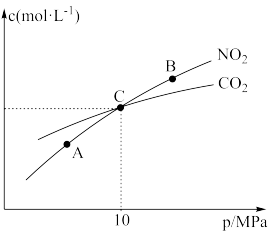
①A、B两点的浓度平衡常数关系为
___________  (填“<”“>”或“=”)。A、B、C三点中,
(填“<”“>”或“=”)。A、B、C三点中, 的平衡转化率最高的是
的平衡转化率最高的是___________ 点(填“A”“B”或“C”)。
②该温度( )下,反应的压强平衡常数
)下,反应的压强平衡常数 =
=___________ MPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)一定温度下,向1L恒容密闭容器中充入0.1mol NO和0.3mol CO,发生可逆反应 。能判断该反应达到平衡状态的依据是___________(填标号)。
。能判断该反应达到平衡状态的依据是___________(填标号)。
(1)用焦炭还原NO的反应为
| 0 | 40 | 80 | 120 | 160 | |
| 2.00 | 1.50 | 1.10 | 0.80 | 0.80 | |
| 1.00 | 0.80 | 0.65 | 0.53 | 0.45 | |
| 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①该反应为
②乙容器在200min达到平衡状态,则0~200min内用NO的浓度变化表示的平均反应速率
(2)用焦炭还原

①A、B两点的浓度平衡常数关系为
②该温度(
(3)一定温度下,向1L恒容密闭容器中充入0.1mol NO和0.3mol CO,发生可逆反应
| A. | B.容器中混合气体的密度保持不变 |
| C. | D.容器中混合气体的平均摩尔质量保持不变 |
21-22高二上·辽宁朝阳·期中
类题推荐
氮的化合物在生产、生活中广泛存在
(1)键能是气态原子形成1mol化学键释放的最低能量。已知下列化学键的键能如表所示,写出1mol气态肼(NH2-NH2)燃烧生成氮气和水蒸气的热化学方程式_________
(2)用焦炭还原NO的反应为:2NO(g)+C(s)  N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
该反应为_____________ (填“放热”或“吸热”)反应乙容器中的反应在60min时达到平衡状态,则0-60min内用NO的浓度变化表示的平均反应速率V(NO)=_________
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s) N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
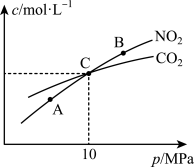
①A、B两点的浓度平衡常数关系:Kc(A)_____________ Kc(B)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是_____________ (填“A”或“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp(C)=____________ (Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(1)键能是气态原子形成1mol化学键释放的最低能量。已知下列化学键的键能如表所示,写出1mol气态肼(NH2-NH2)燃烧生成氮气和水蒸气的热化学方程式
| 化学键 | N≡N | O=O | N-N | N-H | O-H |
| 键能/(kJ/mol) | 946 | 497 | 193 | 391 | 463 |
| t/min | 0 | 10 | 20 | 30 | 40 |
| n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
| n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
| n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
该反应为
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s)

①A、B两点的浓度平衡常数关系:Kc(A)
②A、B、C三点中NO2的转化率最高的是
③计算C点时该反应的压强平衡常数Kp(C)=
氮的化合物在生产生活中广泛存在。
(1)①氯胺( )的电子式为
)的电子式为___________ 。可通过反应 制备氯胺,已知部分化学键的键能如表所示,则上述反应的
制备氯胺,已知部分化学键的键能如表所示,则上述反应的
___________ 。
② 与水反应生成强氧化性的物质,可作长效缓释消毒剂,该反应的化学方程式为
与水反应生成强氧化性的物质,可作长效缓释消毒剂,该反应的化学方程式为___________ 。
(2)用焦炭还原NO的反应为: ,向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中
,向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中 随反应时间t的变化情况如下表所示:
随反应时间t的变化情况如下表所示:
①该正反应为___________ (填“放热”或“吸热”)反应。
②乙容器在200min达到平衡状态,则0~200min内用NO的浓度变化表示的平均反应速率
___________ 。
(3)用焦炭还原 的反应为:
的反应为: ,在恒温条件下,
,在恒温条件下, 和足量C发生该反应,测得平衡时
和足量C发生该反应,测得平衡时 和
和 的物质的量浓度与平衡总压的关系如图所示:
的物质的量浓度与平衡总压的关系如图所示:
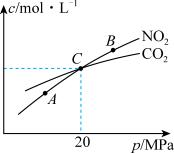
①A、B两点的浓度平衡常数关系:Kc(A)___________ Kc(B) (填“<”“>”或“=”)。
②A、B、C三点中 的转化率最低的是
的转化率最低的是___________ (填“A”“B”或“C”)点。
③计算C点时该反应的压强平衡常数
___________ ( 是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(1)①氯胺(
| 键能/( | 391 | 243 | 191 | 431 |
| 化学键 | N-H | Cl-Cl | N-Cl | H-Cl |
(2)用焦炭还原NO的反应为:
| t/min | 0 | 40 | 80 | 120 | 160 |
| 2.00 | 1.50 | 1.10 | 0.60 | 0.60 | |
| 1.00 | 0.80 | 0.65 | 0.53 | 0.45 | |
| 2.00 | 1.00 | 0.50 | 0.50 | 0.50 |
②乙容器在200min达到平衡状态,则0~200min内用NO的浓度变化表示的平均反应速率
(3)用焦炭还原

①A、B两点的浓度平衡常数关系:Kc(A)
②A、B、C三点中
③计算C点时该反应的压强平衡常数
氮的化合物在生产、生活中广泛存在。
(1)键能是气态基态原子形成1 mol化学键释放的最低能量。已知下列化学键的键能如表所示:
写出1 mol气态肼(H2N-NH2)燃烧生成氮气和水蒸气的热化学方程式:_______ 。
(2)用焦炭还原NO的反应为2NO(g)+C(s)⇌N2(g)+CO2(g),向容积均为1 L的甲、乙、丙三个恒容恒温(反应温度分别为400 ℃、400 ℃、T ℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如表所示。
①该反应为________ (填“放热”或“吸热”)反应。
②乙容器中的反应在60 min时达到平衡状态,则0~60 min内用NO的浓度变化表示的平均反应速率v(NO)=________ 。
(3)用焦炭还原NO2的反应为2NO2(g)+2C(s)⇌N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量焦炭发生反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压强的关系如图所示:
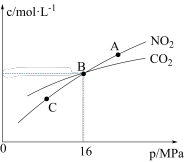
①A、C两点用浓度表示的平衡常数关系:Kc(A)________ (填“<”“>”或“=”)Kc(C)。
②A、B、C三点中NO2的转化率最高的是__________ (填“A”“B”或“C”)点。
③B点时该反应用压强表示的平衡常数Kp(B)=________ (填数值,Kp是用平衡分压代替平衡浓度进行计算,分压=总压×物质的量分数)。
(1)键能是气态基态原子形成1 mol化学键释放的最低能量。已知下列化学键的键能如表所示:
| 化学键 | N≡N | O=O | N—N | N—H | O—H |
| 键能/(kJ·mol-1) | 946 | 497 | 193 | 391 | 463 |
写出1 mol气态肼(H2N-NH2)燃烧生成氮气和水蒸气的热化学方程式:
(2)用焦炭还原NO的反应为2NO(g)+C(s)⇌N2(g)+CO2(g),向容积均为1 L的甲、乙、丙三个恒容恒温(反应温度分别为400 ℃、400 ℃、T ℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如表所示。
| t/min | 0 | 10 | 20 | 30 | 40 |
| n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
| n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
| n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①该反应为
②乙容器中的反应在60 min时达到平衡状态,则0~60 min内用NO的浓度变化表示的平均反应速率v(NO)=
(3)用焦炭还原NO2的反应为2NO2(g)+2C(s)⇌N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量焦炭发生反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压强的关系如图所示:

①A、C两点用浓度表示的平衡常数关系:Kc(A)
②A、B、C三点中NO2的转化率最高的是
③B点时该反应用压强表示的平衡常数Kp(B)=
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


