解答题-原理综合题 适中0.65 引用1 组卷59
回答下列问题:
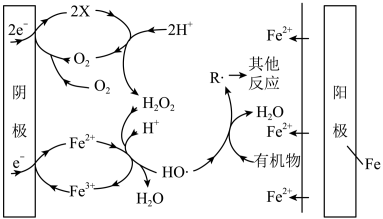
(1)EF、H2O2、FeOx,法可用于水体中有机污染物降解,其反应机理如图所示。阳极的电极反应式为____ ,X微粒的化学式为____ ,阴极附近Fe2+参与反应的离子方程式为___ 。
(2)将一定量的氢基甲酸铵置于恒容真空密闭容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡的是
2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡的是___ 。
a.2v正(NH3)=V逆(CO2)
b.密闭容器中c(NH3):c(CO2)=2:1
c.密闭容器中混合气体的密度不变
d.混合气体压强不再发生变化
e.气体的平均相对分子质量不变
(3)中科院化学所研究了下列反应的反应历程,如图所示:
CH3OH(g)+CO2(g)+H2(g) CH3COOH(g)+H2O(g)
CH3COOH(g)+H2O(g)
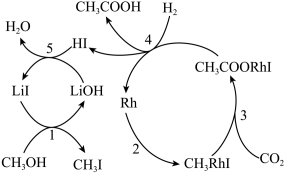
反应历程中,能降低反应活化能的物质有___ (填化学式);中间产物有___ 种。
(1)EF、H2O2、FeOx,法可用于水体中有机污染物降解,其反应机理如图所示。阳极的电极反应式为

(2)将一定量的氢基甲酸铵置于恒容真空密闭容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)
a.2v正(NH3)=V逆(CO2)
b.密闭容器中c(NH3):c(CO2)=2:1
c.密闭容器中混合气体的密度不变
d.混合气体压强不再发生变化
e.气体的平均相对分子质量不变
(3)中科院化学所研究了下列反应的反应历程,如图所示:
CH3OH(g)+CO2(g)+H2(g)

反应历程中,能降低反应活化能的物质有
21-22高二上·福建泉州·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网












