解答题-实验探究题 适中0.65 引用1 组卷34
食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的。
已知:①氧化性:IO >Fe3+>I2;还原性:S2O
>Fe3+>I2;还原性:S2O >I-
>I-
②3I2+6OH-=5I-+IO +3H2O
+3H2O
(1)某学习小组对加碘盐进行了如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得试液分为3份。第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。
①加KSCN溶液显红色,该红色物质是_______ (用化学式表示);CCl4中显紫红色的物质是_______ (用电子式表示)。
②第二份试液中加入足量KI固体后,反应的离子方程式为_______ ,_______ 。
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失。写出潮湿环境中KI与氧气反应的化学方程式:_______ 。
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失。下列物质中有可能作为稳定剂的是_______。
已知:①氧化性:IO
②3I2+6OH-=5I-+IO
(1)某学习小组对加碘盐进行了如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得试液分为3份。第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。
①加KSCN溶液显红色,该红色物质是
②第二份试液中加入足量KI固体后,反应的离子方程式为
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失。写出潮湿环境中KI与氧气反应的化学方程式:
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失。下列物质中有可能作为稳定剂的是_______。
| A.Na2S2O3 | B.AlCl3 | C.Na2CO3 | D.NaNO2 |
21-22高三上·江西九江·阶段练习
类题推荐
根据数据和相关的信息回答下列问题:
Ⅰ.有一装置是用以制备某种干燥的纯净气体,如下图所示:其A中应盛放一种密度比B中密度小的液体。下表中为几种液体的密度:
现从上述液体中选出几种适宜的试剂,利用该装置,制出干燥纯净气体。
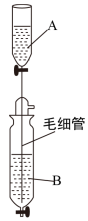
(1)制备出的气体为___________ (化学式)。
(2)装置中毛细管的作用:___________ 。
Ⅱ.已知:①氧化性: ;还原性:
;还原性: 。
。
② ;
;
(3)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分为3份。第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。
①加KSCN溶液显红色,该红色物质是___________ (化学式)。
②该碘盐中加入的含碘元素化合物是___________ (化学式)。
③紫红色物质为碘,写出I2的电子式___________ 。
(4)由于空气中氧气的作用,KI作为加碘剂容易引起碘的损失。写出潮湿环境下KI与氧气反应的化学方程式:___________ 。
(5)将I2溶于KI溶液,在低温条件下,可制得 。某同学认为该物质不适合作为食盐加碘剂,说明理由:
。某同学认为该物质不适合作为食盐加碘剂,说明理由:___________ 。
(6)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失。下列物质有可能作为稳定剂的是___________ (填序号)。
a.Na2S2O3 b.NaNO2 c.Na2CO3
Ⅰ.有一装置是用以制备某种干燥的纯净气体,如下图所示:其A中应盛放一种密度比B中密度小的液体。下表中为几种液体的密度:
| 溶液名称 | 浓盐酸 | 浓硫酸 | 浓氨水 | 浓氢氧化钠溶液 |
| 密度(g/mL) | 1.19 | 1.84 | 0.89 | 1.41 |

(1)制备出的气体为
(2)装置中毛细管的作用:
Ⅱ.已知:①氧化性:
②
(3)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分为3份。第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。
①加KSCN溶液显红色,该红色物质是
②该碘盐中加入的含碘元素化合物是
③紫红色物质为碘,写出I2的电子式
(4)由于空气中氧气的作用,KI作为加碘剂容易引起碘的损失。写出潮湿环境下KI与氧气反应的化学方程式:
(5)将I2溶于KI溶液,在低温条件下,可制得
(6)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失。下列物质有可能作为稳定剂的是
a.Na2S2O3 b.NaNO2 c.Na2CO3
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网