填空题 适中0.65 引用1 组卷112
室温下,向20mL盐酸和硫酸的混合溶液中逐渐滴入0.05mol/L的 溶液,生成的
溶液,生成的 沉淀的质量和pH的变化如图所示(不考虑溶液混合时体积的变化)。
沉淀的质量和pH的变化如图所示(不考虑溶液混合时体积的变化)。
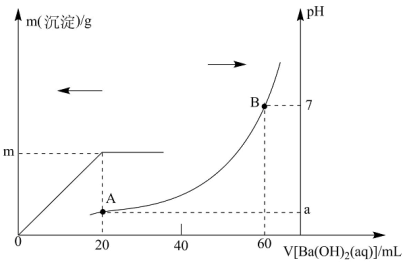
(1)原混合溶液中HCl的物质的量的浓度为___________ 。
(2)图中A点对应溶液的
___________ 。
(3)pH相等的NaOH溶液与 溶液,分别加热到相同的温度后,
溶液,分别加热到相同的温度后, 溶液的pH
溶液的pH___________ NaOH溶液的pH(填“>“=”或“<”)。
(4)将物质的量浓度相同的盐酸与氨水混合后,溶液中的 ,则盐酸的体积
,则盐酸的体积___________ 氨水的体积(填“>“=”或“<”)。
(5)将0.2mol/L HA溶液与0.1mol/L NaOH溶液等体积混合(混合后溶液体积变化忽略不计),测得混合溶液中 ,则:
,则:
①混合溶液中,
___________  (填“>”“=”或“<”,下同)。
(填“>”“=”或“<”,下同)。
②混合溶液中,
___________ 0.1mol/L。
(6)生活中常用明矾作净水剂,其原理是___________ (结合必要的离子方程式说明)。
(7)泡沫灭火器(硫酸铝和碳酸氢钠溶液)的作用原理是___________ (写出离子方程式)
(8)室温下,0.1mol/L的NaHA溶液中,测得溶液显碱性。则该溶液中
___________  (填“>”<”或“=”)。
(填“>”<”或“=”)。
(9)①现有等物质的量浓度的下列五种溶液① 、②
、② 、③
、③ 、④
、④ 、⑤
、⑤ ,溶液中水的电离程度由大到小的排列顺序是
,溶液中水的电离程度由大到小的排列顺序是___________ (填序号)。
② 可以将碘盐中的
可以将碘盐中的 还原为碘单质,试写出此反应的离子方程式:
还原为碘单质,试写出此反应的离子方程式:___________ 。

(1)原混合溶液中HCl的物质的量的浓度为
(2)图中A点对应溶液的
(3)pH相等的NaOH溶液与
(4)将物质的量浓度相同的盐酸与氨水混合后,溶液中的
(5)将0.2mol/L HA溶液与0.1mol/L NaOH溶液等体积混合(混合后溶液体积变化忽略不计),测得混合溶液中
①混合溶液中,
②混合溶液中,
(6)生活中常用明矾作净水剂,其原理是
(7)泡沫灭火器(硫酸铝和碳酸氢钠溶液)的作用原理是
(8)室温下,0.1mol/L的NaHA溶液中,测得溶液显碱性。则该溶液中
(9)①现有等物质的量浓度的下列五种溶液①
②
21-22高二上·新疆乌鲁木齐·阶段练习
知识点:水溶液中水的电离程度及的计算酸碱混合时的定性判断及计算盐类水解规律理解及应用盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 答案解析 【答案】很抱歉,登录后才可免费查看答案和解析! 立即登录
类题推荐
已知常温下部分弱电解质的电离平衡常数如下表:
(1)常温下,物质的量浓度相同的三种溶液①NaF溶液;②NaClO溶液;③ 溶液,其pH由大到小的顺序是
溶液,其pH由大到小的顺序是___________ (填序号)。
(2)浓度均为0.1 mol/L① ;②
;② ;③
;③ ;④氨水;⑤
;④氨水;⑤ 五种溶液中,
五种溶液中, 由大到小的顺序
由大到小的顺序___________ (填序号)。
(3)25℃时,将a mol/L的氨水与0.01 mol/L的盐酸等体积混合,反应完后溶液中 ,用含a的代数式表示
,用含a的代数式表示 的电离平衡常数
的电离平衡常数
___________ 。
(4)泡沫灭火器中盛有 、
、 两种溶液,当它们混合时,发生反应的离子方程式为
两种溶液,当它们混合时,发生反应的离子方程式为___________ 。
(5)室温下, 的NaOH溶液和
的NaOH溶液和 的
的 溶液,设由水电离产生的
溶液,设由水电离产生的 的物质的量浓度分别为A和B,则
的物质的量浓度分别为A和B,则 等于
等于___________ 。
(6)亚磷酸溶液中的 H3PO3、H2PO 、HPO
、HPO 的物质的量分数δ(x)随 c(H+)的变化如图所示。
的物质的量分数δ(x)随 c(H+)的变化如图所示。
已知: 。
。

图像中c点c(H3PO3)=c(HPO ),那c点对应的c(H+)=
),那c点对应的c(H+)=___________ mol/L(只列出计算式)。
(7)25℃时,H3PO4的电离常数为Ka1=7.5×10-3,Ka2=6.2×10-8,Ka3=4.4×10-13。足量NaF溶液和H3PO4溶液反应的离子方程式为___________ 。
| 化学式 | HF | HClO | H3PO3 | ||
| 电离常数 | Ka1=5.0×10-2Ka2=2.6×10-7 |
(1)常温下,物质的量浓度相同的三种溶液①NaF溶液;②NaClO溶液;③
(2)浓度均为0.1 mol/L①
(3)25℃时,将a mol/L的氨水与0.01 mol/L的盐酸等体积混合,反应完后溶液中
(4)泡沫灭火器中盛有
(5)室温下,
(6)亚磷酸溶液中的 H3PO3、H2PO
已知:

图像中c点c(H3PO3)=c(HPO
(7)25℃时,H3PO4的电离常数为Ka1=7.5×10-3,Ka2=6.2×10-8,Ka3=4.4×10-13。足量NaF溶液和H3PO4溶液反应的离子方程式为
(1)请写出泡沫灭火器(硫酸铝和碳酸氢钠溶液) 灭火时发生反应的离子方程式:_______________ 。
(2)常温下若溶液由pH=3的HA溶液V1mL 与pH=11的NaOH溶液V2mL混合而得正确的有_______________ 。
A.若混合后溶液呈中性:c(H+)+c(OH-)=2×10-7mol/L
B.若V1=V2,混合后溶液pH一定等于7
C.若混合后溶液呈酸性,则V1一定大于V2
D.若混合后溶液呈碱性,则V1一定小于V2
(3)常温下,浓度均为0.1mol/L的下列五种溶液的pH如表所示:
①根据表中数据,将浓度均为0.01mo/L的下列四种酸的溶液分别稀释100倍,pH变化最小的是_________ 。
A.HCN B.HClO C.H2CO3 D.CH3COOH
②根据以上数据,判断下列反应可以成立的是_________ 。
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO
D.NaHCO3+HCN=NaCN+H2O+CO2↑
(4)某温度时,测得0.01mol·L-1 的NaOH溶液的pH为10。若将此温度下pH=10的NaOH 溶液aL与pH=1的稀硫酸bL混合,(设混合后溶液体积的微小变化忽略不计),若所得混合液pH=2,则a:b=_______ 。
(5)25℃,用0.1000 mol/LNaOH 溶液滴定20.00mL0.1000mol/L 某一元酸HA溶液所得滴定曲线如图。
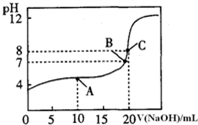
①为减小实验误差,滴定时应选用适当的指示剂,判断该滴定终点的现象为(必须描述颜色的变化)______________________ 。
②A、B、C三点所示溶液导电能力最强的是___________ 点对应的溶液;
③比较A、C两点中水的电离程度:A_______ C (填“>”、“ =”或“<”)。
(6)H2C2O4与含等物质的量的KOH的溶液反应后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为______________________ 。
(7)某酸性CuCl2溶液中含少量的FeCl3,为制得纯净CuCl2溶液,宜加入__________ 调至溶液pH=4,使Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=_________ mol/L。[Fe(OH)3的Ksp=2.6×10-39]
(2)常温下若溶液由pH=3的HA溶液V1mL 与pH=11的NaOH溶液V2mL混合而得正确的有
A.若混合后溶液呈中性:c(H+)+c(OH-)=2×10-7mol/L
B.若V1=V2,混合后溶液pH一定等于7
C.若混合后溶液呈酸性,则V1一定大于V2
D.若混合后溶液呈碱性,则V1一定小于V2
(3)常温下,浓度均为0.1mol/L的下列五种溶液的pH如表所示:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①根据表中数据,将浓度均为0.01mo/L的下列四种酸的溶液分别稀释100倍,pH变化最小的是
A.HCN B.HClO C.H2CO3 D.CH3COOH
②根据以上数据,判断下列反应可以成立的是
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO
D.NaHCO3+HCN=NaCN+H2O+CO2↑
(4)某温度时,测得0.01mol·L-1 的NaOH溶液的pH为10。若将此温度下pH=10的NaOH 溶液aL与pH=1的稀硫酸bL混合,(设混合后溶液体积的微小变化忽略不计),若所得混合液pH=2,则a:b=
(5)25℃,用0.1000 mol/LNaOH 溶液滴定20.00mL0.1000mol/L 某一元酸HA溶液所得滴定曲线如图。

①为减小实验误差,滴定时应选用适当的指示剂,判断该滴定终点的现象为(必须描述颜色的变化)
②A、B、C三点所示溶液导电能力最强的是
③比较A、C两点中水的电离程度:A
(6)H2C2O4与含等物质的量的KOH的溶液反应后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为
(7)某酸性CuCl2溶液中含少量的FeCl3,为制得纯净CuCl2溶液,宜加入
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网



