填空题 适中0.65 引用1 组卷259
物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看作化学平衡的一种,请根据所学化学知识回答下列问题:
(1)已知 溶液呈中性。常温下,浓度均为
溶液呈中性。常温下,浓度均为 的8种溶液:①
的8种溶液:① 溶液;②
溶液;② 溶液;③
溶液;③ 溶液:④
溶液:④ ;⑤
;⑤ 溶液;⑥
溶液;⑥ 溶液;⑦
溶液;⑦ 溶液:⑧
溶液:⑧ 溶液。这些溶液中水的电离程度由大到小的顺序是
溶液。这些溶液中水的电离程度由大到小的顺序是___________ (填序号)。
(2)25℃时,向 的氯化铵溶液中加入
的氯化铵溶液中加入 的氨水,判断铵离子的水解程度如何变化并说明理由:
的氨水,判断铵离子的水解程度如何变化并说明理由:___________ 。
(3)室温下,如果将
 和
和
 全部溶于水,形成混合溶液(假设无损失),两种粒子
全部溶于水,形成混合溶液(假设无损失),两种粒子___________ (填两种粒子的化学式)的物质的量之和比 多
多 。
。
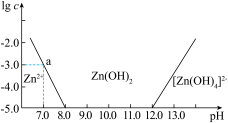
(4)如图所示,横坐标为溶液的 ,纵坐标为
,纵坐标为 或
或 物质的量浓度的对数。回答下列问题:
物质的量浓度的对数。回答下列问题:
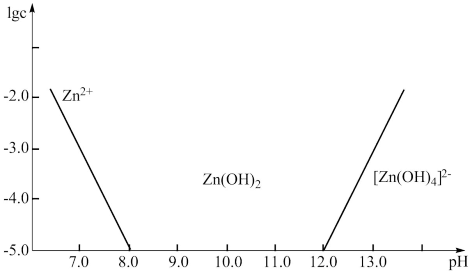
①向 溶液中加入足量的氢氧化钠溶液,写出该反应的化学方程式:
溶液中加入足量的氢氧化钠溶液,写出该反应的化学方程式:___________ 。
②从图中数据计算可得 的溶度积
的溶度积
___________ 。
(5) 饱和溶液中存在:
饱和溶液中存在: ,常温下
,常温下 。
。
①理论上 的溶解度为
的溶解度为___________ g。
②又知 饱和溶液中
饱和溶液中 与
与 之间存在以下限量关系:
之间存在以下限量关系: ,为了使溶液里
,为了使溶液里 达到
达到 ,现将适量
,现将适量 投入其饱和溶液中,应调节溶液中的
投入其饱和溶液中,应调节溶液中的 为
为___________ 。
(1)已知
(2)25℃时,向
(3)室温下,如果将
(4)如图所示,横坐标为溶液的

①向
②从图中数据计算可得
(5)
①理论上
②又知
21-22高二上·河北邢台·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网