解答题-实验探究题 适中0.65 引用3 组卷160
FeCl3、FeCl2在工业生产中有很多用途,其中FeCl2是一种常用的还原剂、媒染剂,某实验小组用如下两种方法来制备无水FeCl2。有关物质的性质如下:
(1)用H2还原无水FeCl3制取FeCl2。有关装置如图1所示:
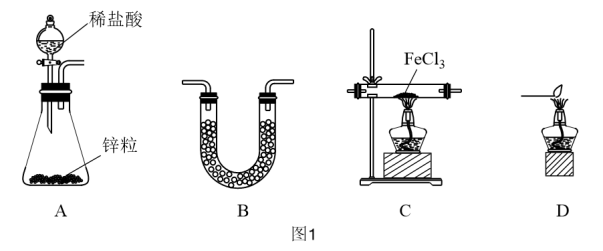
①A装置中装锌粒的仪器名称是___________ 。
②H2还原无水FeCl3制取FeCl2的化学方程式为___________ 。
③按气流由左到右的方向,上述仪器的连接顺序为___________ (填字母,装置可多次使用)。
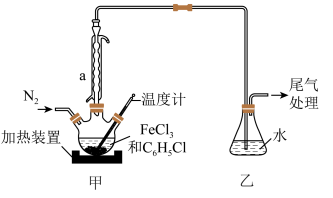
(2)利用反应2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl↑,制取无水FeCl2并测定FeCl3的转化率。按图2装置,在三颈烧瓶中放入32.5g无水氯化铁和过量的氯苯,控制反应温度在一定范围加热3h,冷却、分离提纯得到粗产品。
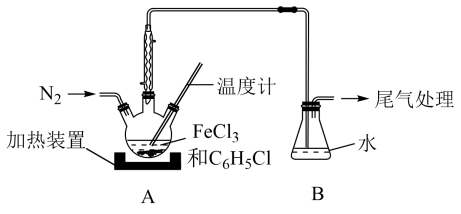
①仪器a的作用是___________ 。
②反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经过滤、洗涤、干燥后,得到粗产品,回收滤液中C6H5Cl的操作方法是___________ 。
③在反应开始之前先通一段时间N2的目的是___________ ,在反应完成后继续通一段时间N2的作用是___________ 。
④反应后将锥形瓶中溶液配成250mL,量取25.00mL所配溶液,用0.40mol•L-1NaOH溶液滴定,重复上述操作3次,达到滴定终点时消耗NaOH溶液的体积分别为19.50mL、20.50mL、19.70mL,则氯化铁的转化率为___________ 。
| C6H5Cl(氯苯) | C6H4Cl2(二氯苯) | FeCl3 | FeCl2 | |
| 溶解性 | 不溶于水,易溶于苯、乙醇 | 不溶于C6H5Cl、C6H2Cl2、苯,易溶于乙醇,易吸水 | ||
| 熔点/℃ | -45 | 53 | 易升华 | |
| 沸点/℃ | 132 | 173 | ||

①A装置中装锌粒的仪器名称是
②H2还原无水FeCl3制取FeCl2的化学方程式为
③按气流由左到右的方向,上述仪器的连接顺序为
(2)利用反应2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl↑,制取无水FeCl2并测定FeCl3的转化率。按图2装置,在三颈烧瓶中放入32.5g无水氯化铁和过量的氯苯,控制反应温度在一定范围加热3h,冷却、分离提纯得到粗产品。

①仪器a的作用是
②反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经过滤、洗涤、干燥后,得到粗产品,回收滤液中C6H5Cl的操作方法是
③在反应开始之前先通一段时间N2的目的是
④反应后将锥形瓶中溶液配成250mL,量取25.00mL所配溶液,用0.40mol•L-1NaOH溶液滴定,重复上述操作3次,达到滴定终点时消耗NaOH溶液的体积分别为19.50mL、20.50mL、19.70mL,则氯化铁的转化率为
21-22高二上·江西宜春·阶段练习
类题推荐
FeCl2是一种常用的还原剂、媒染剂。某化学小组同学在实验室里用如下两种方法来制备无水FeCl2。有关物质的性质如下:
请回答下列问题:
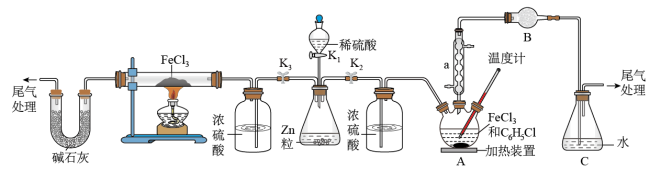
(1)利用反应2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl制取无水FeCl2并测定FeCl3的转化率。按上图装置,在三颈烧瓶中放入32.5g无水氯化铁和过量的氯苯。打开K1、K2,关闭K3,通一段时间H2后关闭K2,控制三颈烧瓶内反应温度在128-139℃,反应一段时间。反应完成后打开K2再通氢气一段时间。
①仪器a的名称是______ ,装置B中盛装的试剂是______ 。
②反应后再通入H2的目的是______ 。
③冷却实验装置,将三颈烧瓶内物质倒出,经过滤、用苯洗涤、干燥后,得到粗产品,回收滤液中C6H5Cl的操作方法是______ 。
④反应后将锥形瓶中溶液配成250mL溶液,取25.00mL所配溶液,用0.4mol•L-1NaOH溶液滴定,消耗NaOH溶液23.60mL,则氯化铁的转化率为______ 。
(2)打开K1、K3,关闭K2,通氢气与氯化铁反应制取无水FeCl2。
①写出反应的化学方程式______ 。
②实验制得FeCl2后并防止氧化的操作是______ 。
③请指出该制备方法的缺点______ 。
| C6H5Cl(氯苯) | C6H4Cl2(二氯苯) | FeCl3 | FeCl2 | |
| 溶解性 | 不溶于水,易溶于苯、乙醇 | 不溶于C6H5Cl、C6H4Cl2、苯,易溶于乙醇,易吸水 | ||
| 熔点/℃ | -45 | 53 | 易升华 | |
| 沸点/℃ | 132 | 173 | - | - |

请回答下列问题:
(1)利用反应2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl制取无水FeCl2并测定FeCl3的转化率。按上图装置,在三颈烧瓶中放入32.5g无水氯化铁和过量的氯苯。打开K1、K2,关闭K3,通一段时间H2后关闭K2,控制三颈烧瓶内反应温度在128-139℃,反应一段时间。反应完成后打开K2再通氢气一段时间。
①仪器a的名称是
②反应后再通入H2的目的是
③冷却实验装置,将三颈烧瓶内物质倒出,经过滤、用苯洗涤、干燥后,得到粗产品,回收滤液中C6H5Cl的操作方法是
④反应后将锥形瓶中溶液配成250mL溶液,取25.00mL所配溶液,用0.4mol•L-1NaOH溶液滴定,消耗NaOH溶液23.60mL,则氯化铁的转化率为
(2)打开K1、K3,关闭K2,通氢气与氯化铁反应制取无水FeCl2。
①写出反应的化学方程式
②实验制得FeCl2后并防止氧化的操作是
③请指出该制备方法的缺点
FeCl2是一种常用的还原剂、媒染剂。某化学实验小组在实验室里用如下方法来制备无水FeCl2。有关物质的性质如下:
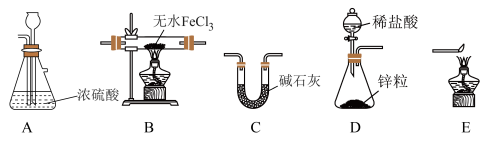
方法一:用H2还原无水FeCl3制取FeCl2。有关装置如下:____________ 。
(2)按气流由左到右的方向,上述仪器的连接顺序为____________。
(3)该制备装置的缺点为____________ 。
方法二:利用反应 制取无水FeCl2,并通过测定HCl的量来计算FeCl3的转化率。按下图装置,在三颈烧瓶中放入32.50g无水氯化铁和过量的氯苯,控制反应温度在一定范围加热3h,冷却并持续通N2一段时间,分离提纯得到粗产品。
制取无水FeCl2,并通过测定HCl的量来计算FeCl3的转化率。按下图装置,在三颈烧瓶中放入32.50g无水氯化铁和过量的氯苯,控制反应温度在一定范围加热3h,冷却并持续通N2一段时间,分离提纯得到粗产品。_____________ 。
(5)仪器b中干燥剂可以选择_____________。
(6)反应结束后恢复至室温,将三颈烧瓶内物质倒出,经过滤、洗涤、干燥后,得到粗产品。洗涤所用最佳试剂是___________ 。
(7)回收滤液中C6H6Cl的操作方法是_____________。
(8)反应后将c中溶液稀释至250mL。量取25.00mL所配溶液,用0.400mol·L-1标准NaOH溶液滴定,终点时消耗标准液19.60mL。则氯化铁的转化率为___________ 。
(9)若反应后通入N2时间不足,则测得氯化铁的转化率______________ 。
A.偏低 B.偏高 C.不影响
(10)制备无水FeCl2需要用到无水FeCl3,某同学提出利用 制备无水FeCl3。你认为该设想是否可行。若不可行,请说明理由;若可行,请简要叙述实验方
制备无水FeCl3。你认为该设想是否可行。若不可行,请说明理由;若可行,请简要叙述实验方_______________ 。
| C6H5Cl(氯苯) | C6H4Cl2(二氯苯) | FeCl3 | FeCl2 | |
| 溶解性 | 不溶于水,易溶于苯、乙醇 | 不溶于C6H5Cl、C6H4Cl2、苯;易溶于乙醇,易吸水 | ||
| 熔点/℃ | -45 | 53 | 100℃时升华 | 672 |
| 沸点/℃ | 132 | 173 | >1000 | |
(2)按气流由左到右的方向,上述仪器的连接顺序为____________。
| A.D→C→B→A→E | B.D→A→B→C→E |
| C.D→B→A→C→E | D.D→C→A→B→E |
(3)该制备装置的缺点为
方法二:利用反应

(5)仪器b中干燥剂可以选择_____________。
| A.碱石灰 | B.无水硫酸铜 | C.无水氯化钙 | D.浓硫酸 |
(6)反应结束后恢复至室温,将三颈烧瓶内物质倒出,经过滤、洗涤、干燥后,得到粗产品。洗涤所用最佳试剂是
(7)回收滤液中C6H6Cl的操作方法是_____________。
| A.萃取 | B.分液 | C.过滤 | D.蒸馏 |
(8)反应后将c中溶液稀释至250mL。量取25.00mL所配溶液,用0.400mol·L-1标准NaOH溶液滴定,终点时消耗标准液19.60mL。则氯化铁的转化率为
(9)若反应后通入N2时间不足,则测得氯化铁的转化率
A.偏低 B.偏高 C.不影响
(10)制备无水FeCl2需要用到无水FeCl3,某同学提出利用
FeCl2是一种净水剂。有关物质的部分性质如下:
某小组用两种方法制备无水FeCl2。
实验(一)氢气还原法:
原理为H2 +2FeCl3 2FeCl2+2HCl。 已知: 焦性没食子酸溶液用于吸收O2。实验室用粗锌和盐酸反应制备氢气,装置如下(装置可以重复使用):
2FeCl2+2HCl。 已知: 焦性没食子酸溶液用于吸收O2。实验室用粗锌和盐酸反应制备氢气,装置如下(装置可以重复使用):
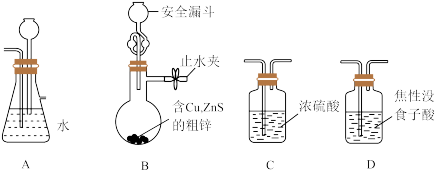
(1)气流从左至右,装置连接顺序为B→A→E→___________ → ___________ →___________ →___________→F。__________
(2)A中长颈漏斗的作用是___________ 。
(3)用简单物理方法验证粗产品中是否含有铁粉:___________ 。
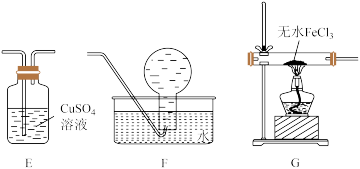
实验(二)氯苯还原法:
原理为2FeCl3 +C6H5Cl 2FeCl2 +C6H4Cl2+HCl↑。装置如图,在三颈烧瓶中放入Wg无水氯化铁和过量的氯苯,反应开始前先通N2一段时间,控制反应温度在129℃~135℃,加热3h, 反应完成后继续通一段时间N2至装置冷却,分离提纯得到粗产品。
2FeCl2 +C6H4Cl2+HCl↑。装置如图,在三颈烧瓶中放入Wg无水氯化铁和过量的氯苯,反应开始前先通N2一段时间,控制反应温度在129℃~135℃,加热3h, 反应完成后继续通一段时间N2至装置冷却,分离提纯得到粗产品。
(4)实验室用氯化铵和亚硝酸钠溶液共热制备N2,制备N2的离子方程式为___________ 。 反应结束后,甲中混合物经冷却、过滤、干燥得到纯净的产品。从剩余混合物中分离出二氯苯的方法是___________ 。
(5)该实验存在缺陷,改进方法是在甲、乙之间增加一个装有下列试剂的干燥管且要在乙中锥形瓶得到盐酸,该干燥管中的试剂可能为___________ (填标号)。
a.浓硫酸 b.无水氯化钙 c.碱石灰 d.五氧化二磷
(6)反应结束后,将锥形瓶中的溶液配成250mL,量取25.00mL所配溶液于另一锥形瓶中,滴几滴甲基橙,用c mol· L-1的NaOH标准溶液滴定,消耗V mL NaOH溶液。理论上FeCl3的转化率为___________ %。
| C6H5Cl(氯苯) | C6H4Cl2(二氯苯) | FeCl3 | FeCl2 | |
| 溶解性 | 不溶于水,易溶于苯、乙醇 | 不溶于C6H5Cl 、C6H4Cl2、苯,易溶于乙醇,易吸水 | ||
| 熔点/℃ | -45 | 53 | 304 | 670 |
| 沸点/℃ | 132 | 173 | 316,易升华 | 700 |
实验(一)氢气还原法:
原理为H2 +2FeCl3


(1)气流从左至右,装置连接顺序为B→A→E→___________ → ___________ →___________ →___________→F。
(2)A中长颈漏斗的作用是
(3)用简单物理方法验证粗产品中是否含有铁粉:
实验(二)氯苯还原法:
原理为2FeCl3 +C6H5Cl

(4)实验室用氯化铵和亚硝酸钠溶液共热制备N2,制备N2的离子方程式为
(5)该实验存在缺陷,改进方法是在甲、乙之间增加一个装有下列试剂的干燥管且要在乙中锥形瓶得到盐酸,该干燥管中的试剂可能为
a.浓硫酸 b.无水氯化钙 c.碱石灰 d.五氧化二磷
(6)反应结束后,将锥形瓶中的溶液配成250mL,量取25.00mL所配溶液于另一锥形瓶中,滴几滴甲基橙,用c mol· L-1的NaOH标准溶液滴定,消耗V mL NaOH溶液。理论上FeCl3的转化率为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


