解答题-原理综合题 适中0.65 引用3 组卷199
氮氧化物气体是造成光化学污染的主要气体,降低氮氧化物气体的排放是环境保护的重要课题。
(1)用 氧化可脱除氮氧化物。已知:
氧化可脱除氮氧化物。已知:
①

②

③

用 氧化脱除NO的总反应是:
氧化脱除NO的总反应是:

___________ ,该反应能够自发向右进行的原因是___________ 。
(2)氮氧化物间的相互转化。已知 的反应历程分两步,
的反应历程分两步,
第一步: (快)
(快)
第二步: (慢)
(慢)
①比较第一步反应的活化能E1与第二步反应的活化能E2大小:E1___________ E2 (填“<”“>”或“=”)。
②某温度下,恒容密闭容器中,充入NO与 的物质的量之比为1:1,体系的总压为40kPa。反应平衡时,
的物质的量之比为1:1,体系的总压为40kPa。反应平衡时, 产率为50%,该温度下反应平衡常数Kp的值为
产率为50%,该温度下反应平衡常数Kp的值为___________ 。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
③绿水青山有利于降低NO的含量,请从化学平衡的角度分析原因___________ 。
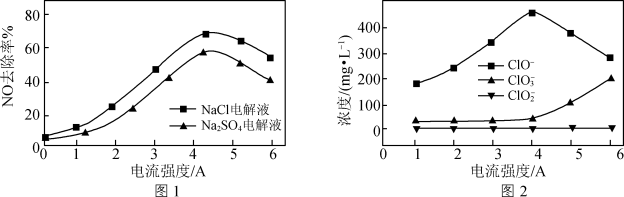
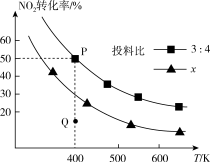
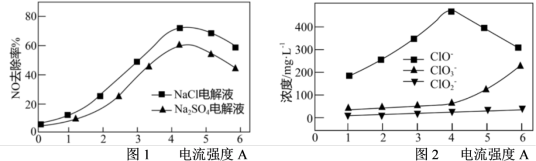
(3)电解氧化吸收法可将废气中的 转变为硝态氮。分别向0.1mol/L NaCl溶液和0.08mol/L
转变为硝态氮。分别向0.1mol/L NaCl溶液和0.08mol/L 溶液(起始pH均调至9)中通入
溶液(起始pH均调至9)中通入 测得电流强度与NO的脱除率的关系如图a所示。电解0.1mol/L NaCl溶液时,溶液中相关成分的浓度变化与电流强度的关系如图b所示。
测得电流强度与NO的脱除率的关系如图a所示。电解0.1mol/L NaCl溶液时,溶液中相关成分的浓度变化与电流强度的关系如图b所示。

①电解 溶液时产生
溶液时产生 ,写出阳极电极反应式为
,写出阳极电极反应式为___________ 。
②电解NaCl溶液作吸收液时,若选择电流强度为4A,写出吸收NO的主要离子反应方程式___________ 。
③相较而言, 溶液作
溶液作 的电解吸收液没有NaCl溶液效果好,随着电流强度的增大,
的电解吸收液没有NaCl溶液效果好,随着电流强度的增大, 溶液NO去除率下降的原因是
溶液NO去除率下降的原因是___________ 。
(1)用
①
②
③
用
(2)氮氧化物间的相互转化。已知
第一步:
第二步:
①比较第一步反应的活化能E1与第二步反应的活化能E2大小:E1
②某温度下,恒容密闭容器中,充入NO与
③绿水青山有利于降低NO的含量,请从化学平衡的角度分析原因
(3)电解氧化吸收法可将废气中的

①电解
②电解NaCl溶液作吸收液时,若选择电流强度为4A,写出吸收NO的主要离子反应方程式
③相较而言,
21-22高三上·湖南·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网