解答题-实验探究题 较难0.4 引用2 组卷446
纯碱和小苏打都是重要的化工原料,在生产和生活中有着广泛的应用。
(1)实验室中需0.2mol/L的 溶液980mL,配制时应选用容量瓶的规格和称取
溶液980mL,配制时应选用容量瓶的规格和称取 的质量分别是_______。
的质量分别是_______。
(2)碳酸钠和碳酸氢钠的鉴别与稳定性探究。
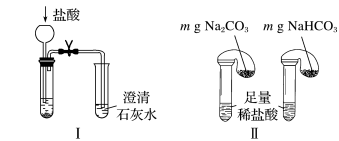
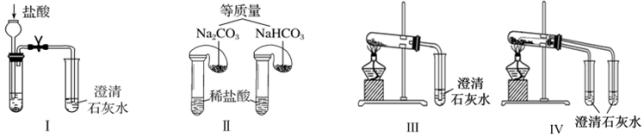
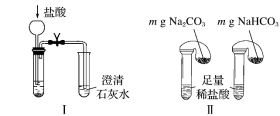
①只根据图Ⅰ、Ⅱ所示实验,能够达到鉴别目的的是_______ (填装置序号)。
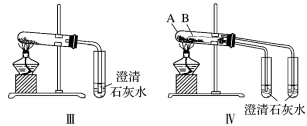
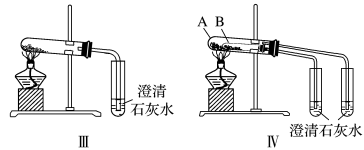
②图Ⅲ、Ⅳ中_______ 能更好说明二者的稳定性(填装置序号)。Ⅳ中受热处发生反应的化学方程式:_______ 。
(3)利用图Ⅲ的装置加热 和
和 的混合物,剩余固体成分会随二者物质的量不同而发生变化。当
的混合物,剩余固体成分会随二者物质的量不同而发生变化。当 充分混合后,加热至完全反应,试管内剩余的固体是
充分混合后,加热至完全反应,试管内剩余的固体是_______ (填化学式)。
(1)实验室中需0.2mol/L的
| A.500mL;21.2g | B.900mL;20.1g | C.1000mL;20.1g | D.1000mL;21.2g |


①只根据图Ⅰ、Ⅱ所示实验,能够达到鉴别目的的是
②图Ⅲ、Ⅳ中
(3)利用图Ⅲ的装置加热
21-22高一上·黑龙江大庆·期中
类题推荐
纯碱和小苏打都是重要的化工原料,在生产和生活中有着广泛的应用。
(1)实验室中需0.2mol/L的Na2CO3溶液980mL,配制时应选用容量瓶的规格和称取Na2CO3的质量分别是 。
(2)碳酸钠和碳酸氢钠的鉴别与稳定性探究。
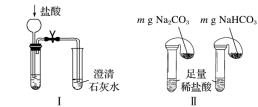
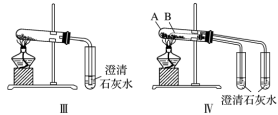
①只根据图I、II所示实验,能够达到鉴别目的的是_______ (填装置序号)。
②图III、IV中能更好说明二者的稳定性_______ (填装置序号)。
(3)某种市售食用碱是纯碱与小苏打的混合物,可大量应用于食品加工,如:面条、面包、馒头等,某校化学兴趣小组利用如图所示装置进行实验测定此种食用碱中纯碱的质量分数。
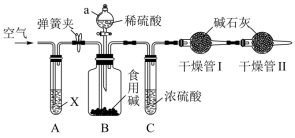
实验步骤:①检查装置的气密性,称取样品(仅由纯碱与小苏打组成)10g,加到装置B中;
②连接装置,打开弹簧夹,先通一段时间空气后,关闭弹簧夹,打开分液漏斗活塞滴入稀硫酸至不再有气体生成;
③关闭分液漏斗的活塞,打开弹簧夹,继续通入一段时间空气。实验中记录的数据如表所示:
请回答下列问题:
①试剂X为_______ ,实验开始前,先打开弹簧夹,通入一段时间空气,其目的为_______ ,实验结束后,需要继续通入一段时间的空气,其目的是:_______ 。
②通过实验数据计算,食用碱中Na2CO3的质量分数为_______ (保留三位有效数字)。
(1)实验室中需0.2mol/L的Na2CO3溶液980mL,配制时应选用容量瓶的规格和称取Na2CO3的质量分别是 。
| A.500mL;21.2g | B.900mL;20.1g | C.1000mL;20.1g | D.1000mL;21.2g |


①只根据图I、II所示实验,能够达到鉴别目的的是
②图III、IV中能更好说明二者的稳定性
(3)某种市售食用碱是纯碱与小苏打的混合物,可大量应用于食品加工,如:面条、面包、馒头等,某校化学兴趣小组利用如图所示装置进行实验测定此种食用碱中纯碱的质量分数。

实验步骤:①检查装置的气密性,称取样品(仅由纯碱与小苏打组成)10g,加到装置B中;
②连接装置,打开弹簧夹,先通一段时间空气后,关闭弹簧夹,打开分液漏斗活塞滴入稀硫酸至不再有气体生成;
③关闭分液漏斗的活塞,打开弹簧夹,继续通入一段时间空气。实验中记录的数据如表所示:
| 装置B | 装置C | 干燥管I | |
| 实验前称得的质量/g | 180.0 | 30.0 | 120.4 |
| 实验后称得的质量/g | 174.2 | 31.5 | 124.8 |
①试剂X为
②通过实验数据计算,食用碱中Na2CO3的质量分数为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网