解答题-原理综合题 适中0.65 引用1 组卷71
铁及其化合物在生产、生活中有广泛的应用。回答下列问题:
(1)复合氧化物铁酸锰( )可用于热化学循环分解制氢气,原理如下:
)可用于热化学循环分解制氢气,原理如下:
① ;
;
② ;
;
③
则
___________ (用 、
、 表示)。
表示)。
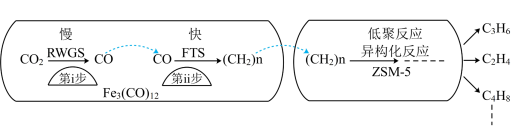
(2)用 催化
催化 加氢合成低碳烯烃反应,反应过程如图。催化剂中添加助剂Na、K、Cu(也起催化作用)后可改变反应的选择性。
加氢合成低碳烯烃反应,反应过程如图。催化剂中添加助剂Na、K、Cu(也起催化作用)后可改变反应的选择性。
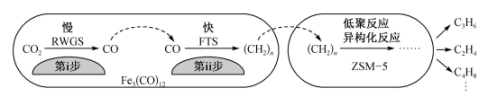
①第i步所发生反应的化学方程式为___________ 。
②下列说法错误的是___________ (填字母)。
A.第i步反应的活化能高于第ii步反应的活化能
B. 使
使 加氢合成低碳烯烃的
加氢合成低碳烯烃的 减小
减小
C.添加不同助剂后,各反应的平衡常数不变
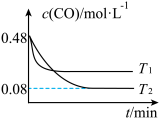
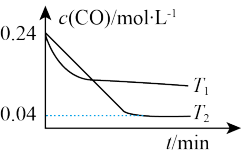
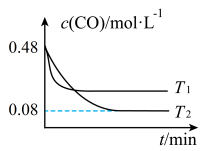
(3)纳米铁是重要的储氢材料,可用反应 制得。在1 L恒容密闭容器中加入足量铁粉和0.48 mol CO,在
制得。在1 L恒容密闭容器中加入足量铁粉和0.48 mol CO,在 、
、 不同温度下进行反应,测得
不同温度下进行反应,测得 与温度、时间的关系如图所示。
与温度、时间的关系如图所示。
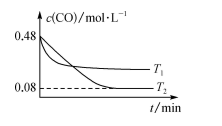
①
___________ (填“>”或“<”,下同) ,
,
___________ 0。
② 温度下,平衡时体系的压强为p,反应的标准平衡常数
温度下,平衡时体系的压强为p,反应的标准平衡常数
___________ {已知:标准平衡 ,其中
,其中 为标准压强(
为标准压强( ),
), 、
、 为各组分的平衡分压}。
为各组分的平衡分压}。
(1)复合氧化物铁酸锰(
①
②
③
则
(2)用

①第i步所发生反应的化学方程式为
②下列说法错误的是
A.第i步反应的活化能高于第ii步反应的活化能
B.
C.添加不同助剂后,各反应的平衡常数不变
(3)纳米铁是重要的储氢材料,可用反应

①
②
21-22高二上·湖北宜昌·期中
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网

 CO+H2O
CO+H2O