填空题 适中0.65 引用4 组卷707
当今,世界各国相继规划了碳达峰、碳中和的时间节点。因此,研发CO2利用技术、降低CO2含量成为研究热点。某化学实验小组采用CO2催化加氢制甲醇来减少CO2对环境造成的影响。在容积为4L的恒容密闭容器中,充入 和
和 ,发生反应:
,发生反应: 。回答下列问题:
。回答下列问题:
(1)每消耗 ,该反应放出的热量为
,该反应放出的热量为___________ kJ。
(2)下列能用来判断该反应达到平衡状态的标志是___________(填标号)。
(3)3min后,反应达到平衡状态,此时测得反应前后的总压强之比为5∶4。
①
___________ mol/L, 的转化率为
的转化率为___________ %。
②
___________  。
。
③该反应达到平衡时的平衡常数K=___________ (列出计算式即可) 。
。
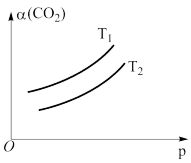
(4)在一定条件下,体系中的CO2的平衡转化率( )与温度(T)和压强(p)的关系如图所示。则T1
)与温度(T)和压强(p)的关系如图所示。则T1___________ (填“>”或“<”)T2,判断的理由是___________ 。
(1)每消耗
(2)下列能用来判断该反应达到平衡状态的标志是___________(填标号)。
| A.混合气体的密度不再随时间改变 | B.混合气体的平均相对分子质量不再随时间改变 |
| C. | D.混合气体的质量不再随时间改变 |
①
②
③该反应达到平衡时的平衡常数K=
(4)在一定条件下,体系中的CO2的平衡转化率(

21-22高二上·湖南·期中
类题推荐
当今,世界各国相继规划了碳达峰、碳中和的时间节点。因此,研发 利用技术、降低空气中
利用技术、降低空气中 含量成为了研究热点。为减少
含量成为了研究热点。为减少 对环境造成的影响,可采用以下方法将其资源化利用。
对环境造成的影响,可采用以下方法将其资源化利用。
(1) 催化加氢制甲醇
催化加氢制甲醇
一定温度下,在某恒容密闭容器中充入一定量的 和
和 ,发生反应:
,发生反应: 。下列叙述能说明该反应已达到平衡状态的是___________(填标号)
。下列叙述能说明该反应已达到平衡状态的是___________(填标号)
(2) 催化加氢合成乙烯
催化加氢合成乙烯
在10 L某恒容密闭容器中,充入1.4mol 和4.2mol
和4.2mol  发生反应:
发生反应:
 。反应达到平衡时,四种组分的物质的量分数
。反应达到平衡时,四种组分的物质的量分数 随温度
随温度 的变化如图所示。
的变化如图所示。

①该反应的
___________ (填“>”或“<”)0,曲线Ⅰ和曲线Ⅱ分别表示___________ (填化学式,下同)和___________ 的变化曲线。
②根据图中a点,计算该温度时的
___________ mol,
___________  ,
, 的平衡转化率为
的平衡转化率为___________ %(保留三位有效数字)。
③若平衡时a点的压强为0.25 MPa,则该反应的平衡常数
___________  (列出计算式,用分压表示,分压=总压×物质的量分数)
(列出计算式,用分压表示,分压=总压×物质的量分数)
(3) 用途广泛,写出其基于物理性质的一种用途:
用途广泛,写出其基于物理性质的一种用途:___________ 。
(1)
一定温度下,在某恒容密闭容器中充入一定量的
| A.混合气体的密度不再随时间变化而改变 |
| B.气体的压强不再随时间变化而改变 |
| C. |
| D.单位时间内每形成1.5mol H-H键,同时形成1mol C-H键 |
在10 L某恒容密闭容器中,充入1.4mol

①该反应的
②根据图中a点,计算该温度时的
③若平衡时a点的压强为0.25 MPa,则该反应的平衡常数
(3)
当今世界多国相继规划了碳达峰、碳中和的时间节点,中国承诺2030年前,二氧化碳的排放不再增长,达到峰值之后逐步降低。2060年前实现“碳中和”,体现了中国对解决气候问题的大国担当。因此,降低空气中二氧化碳含量成为研究热点,其中研发二氧化碳的利用技术,将二氧化碳转化为能源是缓解环境和解决能源问题的方案之一。
I.二氧化碳在一定条件下转化为甲烷,其反应过程如下图所示。
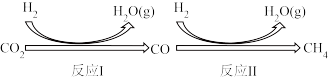
已知:CO2(g)+4H2(g) CH4(g)+2H2O(g)△H1=-205kJ·mol-1
CH4(g)+2H2O(g)△H1=-205kJ·mol-1
反应II:CO(g)+3H2(g) CH4(g)+H2O(g)△H2=-246kJ·mol-1
CH4(g)+H2O(g)△H2=-246kJ·mol-1
(1)则反应I的热化学方程式为_______ 。
(2)一定条件下,向2L恒容密闭容器中加入1molCO2和5molH2,只发生上述反应I和反应II;10min后容器内总压强(P)不再变化,容器中CH4为0.6mol,CO2为0.2mol,H2O为1.4mol,10min内H2的平均反应速率v(H2)=_______ 反应II的平衡常数Kp=_______ (用含字母P的代数式表示,已知Kp是用反应体系中气体物质的分压来表示的平衡常数,即将K表达式中平衡浓度用平衡分压代替,某气体分压=气体总压强×该气体的物质的量分数)
II.在催化剂作用下CO2加氢还可制得甲醇CO2(g)+3H2(g) CH3OH(g)+H2O(g)∆H=50kJ/mol。
CH3OH(g)+H2O(g)∆H=50kJ/mol。
(3)能说明反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=50kJ/mol已达平衡状态的是_______(填字母)。
CH3OH(g)+H2O(g)△H=50kJ/mol已达平衡状态的是_______(填字母)。
III.CO2与H2催化重整制备CH3OCH3的过程中存在反应:
①2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g)△H<0;
CH3OCH3(g)+3H2O(g)△H<0;
②CO2(g)+H2(g) CO(g)+H2O(g)△H>0。
CO(g)+H2O(g)△H>0。
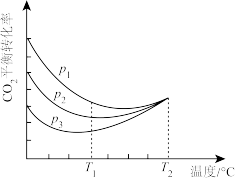
(4)向密闭容器中以物质的量之比为1:3充入CO2与H2,实验测得CO2的平衡转化率随温度和压强的变化关系如图所示。P1、P2、P3由大到小的顺序为_______ ;T2°C时主要发生反应_______ 。(填“①”或“②”),CO2平衡转化率随温度变化先降后升的原因为_______ 。
I.二氧化碳在一定条件下转化为甲烷,其反应过程如下图所示。
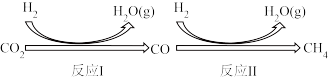
已知:CO2(g)+4H2(g)
反应II:CO(g)+3H2(g)
(1)则反应I的热化学方程式为
(2)一定条件下,向2L恒容密闭容器中加入1molCO2和5molH2,只发生上述反应I和反应II;10min后容器内总压强(P)不再变化,容器中CH4为0.6mol,CO2为0.2mol,H2O为1.4mol,10min内H2的平均反应速率v(H2)=
II.在催化剂作用下CO2加氢还可制得甲醇CO2(g)+3H2(g)
(3)能说明反应CO2(g)+3H2(g)
| A.单位时间内生成1molCH3OH(g)的同时消耗了3molH2(g) |
| B.在恒温恒容的容器中,混合气体的密度保持不变 |
| C.在绝热恒容的容器中,反应的平衡常数不再变化 |
| D.在恒温恒压的容器中,气体的平均摩尔质量不再变化 |
III.CO2与H2催化重整制备CH3OCH3的过程中存在反应:
①2CO2(g)+6H2(g)
②CO2(g)+H2(g)
(4)向密闭容器中以物质的量之比为1:3充入CO2与H2,实验测得CO2的平衡转化率随温度和压强的变化关系如图所示。P1、P2、P3由大到小的顺序为

当今,世界各国相继规划了碳达峰、碳中和的时间节点。因此,研发 利用技术、降低空气中
利用技术、降低空气中 含量成为了研究热点。为减少
含量成为了研究热点。为减少 对环境造成的影响,可采用以下方法将其资源化利用。
对环境造成的影响,可采用以下方法将其资源化利用。
(1) 催化加氢制甲醇
催化加氢制甲醇
一定温度下,在某恒容密闭容器中充入一定量的 和
和 ,发生反应:
,发生反应: 。下列叙述能说明该反应已达到平衡状态的是_______(填标号)。
。下列叙述能说明该反应已达到平衡状态的是_______(填标号)。
(2) 催化加氢合成乙烯
催化加氢合成乙烯
在 某恒容密闭容器中,充入
某恒容密闭容器中,充入 和
和 ,发生反应:
,发生反应: 。反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图所示。
。反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图所示。

①该反应的
_______ (填“>”或“<”)0,曲线Ⅰ和曲线Ⅱ分别表示_______ (填化学式,下同)和_______ 的变化曲线。
②根据图中a点,计算该温度下平衡时的
_______  ,
,
_______  ,
, 的平衡转化率为
的平衡转化率为_______  (保留三位有效数字)。
(保留三位有效数字)。
③若平衡时a点容器内气体的总压强为 ,则该反应的平衡常数
,则该反应的平衡常数
_______  (列出计算式,用分压表示,分压
(列出计算式,用分压表示,分压 总压
总压 物质的量分数)。
物质的量分数)。
(3) 用途广泛,写出其基于物理性质的一种用途:
用途广泛,写出其基于物理性质的一种用途:_______ 。
(1)
一定温度下,在某恒容密闭容器中充入一定量的
| A.混合气体的密度不再随时间变化而改变 |
| B.气体的压强不再随时间变化而改变 |
| C. |
| D.单位时间内每形成 |
在

①该反应的
②根据图中a点,计算该温度下平衡时的
③若平衡时a点容器内气体的总压强为
(3)
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


