解答题-原理综合题 适中0.65 引用2 组卷105
SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。
(1)SCR(选择性催化还原)工作原理:
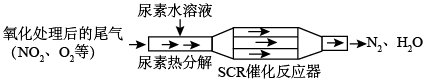
尿素[CO(NH2)2]水溶液热分解为NH3和CO2,请写出CO2的电子式___________ 。
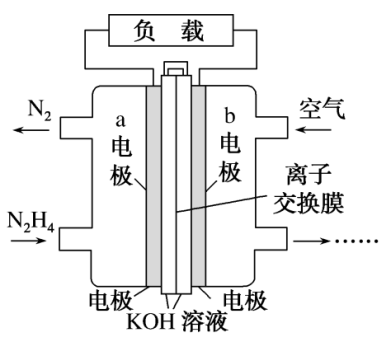
(2)肼(N2H4)可以用作燃料电池的原料。肼的结构式为___________ ;一种以液态肼为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。a电极是电极的___________ 极(填“正”或“负”),a电极的电极反应式为___________ 。
(3)已知:N2(g)+O2(g)=2NO(g)△H1=+180.5kJ·mol-1
C(s)+O2(g)=CO2(g)△H2=-393.5kJ·mol-1
2C(s)+O2(g)=2CO(g)△H3=-221.0kJ·mol-1
若某反应的平衡常数表达式为K= ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式___________ 。
(4)已知植物光合作用发生的反应如下:6CO2(g)+6H2O(l)⇌C6H12O6(s)+6O2(g)△H=+669.62kJ/mol,该反应达到化学平衡后,若改变下列条件,CO2转化率增大的是___________ 。
a.增大CO2的浓度b.取走一半C6H12O6c.加入催化剂d.适当升高温度
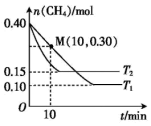
(5)N2O5的分解反应2N2O5(g)⇌4NO2(g)+O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
计算在0~2min时段,化学反应速率v(NO2)=___________ mol∙L-1∙min-1。
(1)SCR(选择性催化还原)工作原理:

尿素[CO(NH2)2]水溶液热分解为NH3和CO2,请写出CO2的电子式
(2)肼(N2H4)可以用作燃料电池的原料。肼的结构式为

(3)已知:N2(g)+O2(g)=2NO(g)△H1=+180.5kJ·mol-1
C(s)+O2(g)=CO2(g)△H2=-393.5kJ·mol-1
2C(s)+O2(g)=2CO(g)△H3=-221.0kJ·mol-1
若某反应的平衡常数表达式为K=
(4)已知植物光合作用发生的反应如下:6CO2(g)+6H2O(l)⇌C6H12O6(s)+6O2(g)△H=+669.62kJ/mol,该反应达到化学平衡后,若改变下列条件,CO2转化率增大的是
a.增大CO2的浓度b.取走一半C6H12O6c.加入催化剂d.适当升高温度
(5)N2O5的分解反应2N2O5(g)⇌4NO2(g)+O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
| C(N2O5)/(mol·L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
计算在0~2min时段,化学反应速率v(NO2)=
21-22高三上·黑龙江·阶段练习
类题推荐
碳、氮是中学化学重要的非金属元素,在生产、生活中有广泛的应用。
(1)治理汽车尾气中NO和CO的一种方法是:在汽车的排气管道上安装一个催化转化装置,使NO与CO反应,产物都是空气中的主要成分。写出该反应的热化学方程式___ 。
已知:①N2(g)+O2(g)=2NO(g)△H=+179.5kJ/mol
②2NO(g)+O2(g)=2NO2(g)△H=-112.3kJ/mol
③NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234kJ/mol
(2)已知植物光合作用发生的反应如下:
6CO2(g)+6H2O(l) C6H12O6(s)+6O2(g)△H=+669.62 kJ/mol
C6H12O6(s)+6O2(g)△H=+669.62 kJ/mol
该反应达到化学平衡后,若改变下列条件,CO2转化率增大的是___ 。
a.增大CO2的浓度b.取走一半C6H12O6c.加入催化剂d.适当升高温度
(3)N2O5的分解反应2N2O5(g) 4NO2(g)+O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
4NO2(g)+O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
计算在0~2min时段,化学反应速率v(NO2)=___ mol•L-1•min-1。
(4)新的研究表明,可以将CO2转化为炭黑进行回收利用,反应原理如图所示。
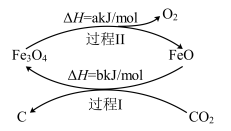
①在转化过程中起催化作用的物质是___ ;
②写出总反应的化学方程式___ 。
(5)工业上以NH3和CO2为原料合成尿素[CO(NH2)2),反应的化学方程式如下:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(l)
CO(NH2)2(l)+H2O(l)
根据上述反应,填写下列空白
①已知该反应可以自发进行,则△H___ 0。(填“>”、“<”或“=”);
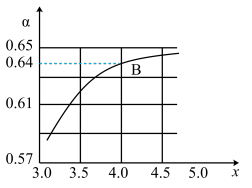
②一定温度和压强下,若原料气中的NH3和CO2的物质的量之比 =x,如图是x与CO2的平衡转化率(α)的关系。α随着x增大而增大的原因是
=x,如图是x与CO2的平衡转化率(α)的关系。α随着x增大而增大的原因是___ ;B点处,NH3的平衡转化率为___ 。
③一定温度下,在3L定容密闭容器中充入NH3和CO2,若x=2,当反应后气体压强变为起始时气体压强的 时达到平衡,测得此时生成尿素90g。该反应的平衡常数K=
时达到平衡,测得此时生成尿素90g。该反应的平衡常数K=___ 。
(1)治理汽车尾气中NO和CO的一种方法是:在汽车的排气管道上安装一个催化转化装置,使NO与CO反应,产物都是空气中的主要成分。写出该反应的热化学方程式
已知:①N2(g)+O2(g)=2NO(g)△H=+179.5kJ/mol
②2NO(g)+O2(g)=2NO2(g)△H=-112.3kJ/mol
③NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234kJ/mol
(2)已知植物光合作用发生的反应如下:
6CO2(g)+6H2O(l)
该反应达到化学平衡后,若改变下列条件,CO2转化率增大的是
a.增大CO2的浓度b.取走一半C6H12O6c.加入催化剂d.适当升高温度
(3)N2O5的分解反应2N2O5(g)
| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
| C(N2O5)/(mol·L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
(4)新的研究表明,可以将CO2转化为炭黑进行回收利用,反应原理如图所示。

①在转化过程中起催化作用的物质是
②写出总反应的化学方程式
(5)工业上以NH3和CO2为原料合成尿素[CO(NH2)2),反应的化学方程式如下:2NH3(g)+CO2(g)
根据上述反应,填写下列空白
①已知该反应可以自发进行,则△H
②一定温度和压强下,若原料气中的NH3和CO2的物质的量之比

③一定温度下,在3L定容密闭容器中充入NH3和CO2,若x=2,当反应后气体压强变为起始时气体压强的
碳、氮是重要的非金属元素,在生产、生活中有广泛的应用。
(1)已知植物光合作用发生的反应如下:6CO2(g)+6H2O(l) C6H12O6(s)+6O2(g) △H=+669.62 kJ•mol-1该反应达到化学平衡后,若改变下列条件,CO2转化率增大的是
C6H12O6(s)+6O2(g) △H=+669.62 kJ•mol-1该反应达到化学平衡后,若改变下列条件,CO2转化率增大的是__________ 。
a.增大CO2的浓度 b.取走一半C6H12O6
c.加入催化剂 d.适当升高温度
(2)N2O5的分解反应2N2O5(g) 4NO2(g) + O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
4NO2(g) + O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
计算在0~2min时段,化学反应速率v(NO2) =________ mol•L-1•min-1。
(3)若将NO2与O2通入甲中设计成如图所示装置,D电极上有红色物质析出,则A电极处通入的气体为_________ (填化学式);A电极的电极反应式为_______________________ ,一段时间后,若乙中需加0.2 mol Cu(OH)2使溶液复原,则转移的电子的物质的量为 _____________ 。

(4)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g) N2(g)+2CO2(g) ΔH=-759.8 kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如下图
N2(g)+2CO2(g) ΔH=-759.8 kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如下图

①b点时,平衡体系中C、N原子个数之比接近________________ ;
②a、b、c三点CO的转化率从大到小的顺序为____________ ;a、c、d三点的平衡常数从大到小的顺序为__________________ 。
③若 =0.8,反应达平衡时,N2的体积分数为20%,则CO的转化率为
=0.8,反应达平衡时,N2的体积分数为20%,则CO的转化率为___________ 。
(1)已知植物光合作用发生的反应如下:6CO2(g)+6H2O(l)
a.增大CO2的浓度 b.取走一半C6H12O6
c.加入催化剂 d.适当升高温度
(2)N2O5的分解反应2N2O5(g)
| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
| c(N2O5) /(mol•L﹣1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
(3)若将NO2与O2通入甲中设计成如图所示装置,D电极上有红色物质析出,则A电极处通入的气体为

(4)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)

①b点时,平衡体系中C、N原子个数之比接近
②a、b、c三点CO的转化率从大到小的顺序为
③若
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网