解答题-原理综合题 适中0.65 引用1 组卷177
当今,世界多国相继规划了碳达峰、碳中和的时间节点,我国力争于2030年前做到碳达峰,2060年前实现碳中和。因此,研发二氧化碳利用技术,降低空气中二氧化碳的含量成为研究热点。
(1)大气中的二氧化碳主要来自于煤、石油及其他含碳化合物的燃烧。已知25℃时,相关物质的燃烧热数据如下表:
则25℃时H2(g)和C(石墨,s)生成C6H6(l)的热化学方程式为__________ 。
(2)
(3)以CO2、H2为原料合成CH3OH的主要反应如下:
I.
II.
III.
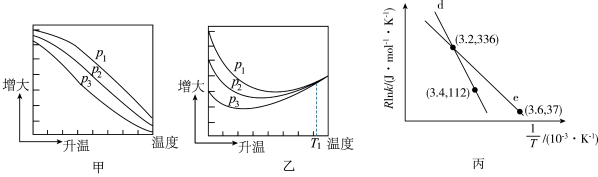
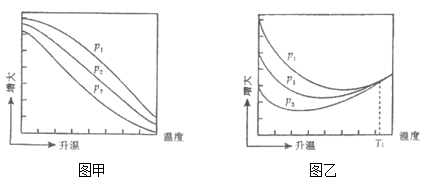
不同压强下,按照 投料,实验测得CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
投料,实验测得CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
已知:CO2的平衡转化率=
CH3OH的平衡产率=
其中纵坐标表示CO2平衡转化率的是图_____ (填“甲”或“乙”);压强P1、P2、P3由大到小的顺序为____ ;图乙中T1温度时,三条曲线几乎交于一点的原因是_______ 。
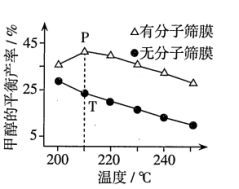
(4)恒压下,按照 投料发生反应I,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的平衡产率随温度的变化如图所示(分子筛膜具有选择透过性)。P点甲醇的平衡产率高于T点的原因可能是
投料发生反应I,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的平衡产率随温度的变化如图所示(分子筛膜具有选择透过性)。P点甲醇的平衡产率高于T点的原因可能是_________ 。
(1)大气中的二氧化碳主要来自于煤、石油及其他含碳化合物的燃烧。已知25℃时,相关物质的燃烧热数据如下表:
| 物质 | H2(g) | C(石墨,s) | C6H6(l) |
| 燃烧热 |
(2)
(3)以CO2、H2为原料合成CH3OH的主要反应如下:
I.
II.
III.
不同压强下,按照

已知:CO2的平衡转化率=
CH3OH的平衡产率=
其中纵坐标表示CO2平衡转化率的是图
(4)恒压下,按照

21-22高二上·山西太原·期中
类题推荐
当今,世界多国相继规划了碳达峰、碳中和的时间节点。因此,研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。
(1)大气中的二氧化碳主要来自于煤、石油及其他含碳化合物的燃烧。已知25 ℃时,相关物质的燃烧热数据如表:
则25 ℃时H2(g)和C(石墨,s)生成C6H6(l)的热化学方程式为___________ 。
Ⅰ.利用CO2制备CO
(2)CO2(g)+H2(g) CO(g)+H2O(g) ,一定条件下,向体积为2L的恒容密闭容器中通入2 mol CO2和6 mol H2发生上述反应,经5 min达到平衡时,容器中CO(g)为1.2 mol 。
CO(g)+H2O(g) ,一定条件下,向体积为2L的恒容密闭容器中通入2 mol CO2和6 mol H2发生上述反应,经5 min达到平衡时,容器中CO(g)为1.2 mol 。
①这段时间内以H2O(g)表示的化学反应速率为___________ 。
②求该反应的平衡常数
___________ 。
③下列事实能说明上述反应达到化学平衡状态的是___________ (填字母序号)。
A.体系内 B.体系压强不再发生变化
B.体系压强不再发生变化
C.体系内密度不再发生变化 D.体系内CO的物质的量分数不再发生变化
Ⅱ.利用 制备甲醇 (CH3OH)
制备甲醇 (CH3OH)
一定条件下,向恒容密闭容器中通入一定量的 和
和 ,涉及反应如下:
,涉及反应如下:
主反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g) 
副反应:CO2(g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g) 
已知:将CO2与H2按照一定流速通过催化剂反应,测得CO2的转化率与产物的选择性[CH3OH选择性= ×100%]随温度变化如图所示:
×100%]随温度变化如图所示:
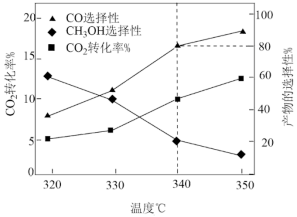
(3)340℃下,原料气通入10molCO2和一定量H2相同流速通过催化剂反应,出口处测得气体中n(CO)=___________ 。
(4)由图可知,随着温度的升高, 转化率升高,
转化率升高, 产率下降,解释其原因:
产率下降,解释其原因:___________ 。
Ⅲ.利用 生产其他含碳化合物
生产其他含碳化合物
(5)电催化还原CO2生成含碳产物(如CO、HCOOH等)原理如图所示:
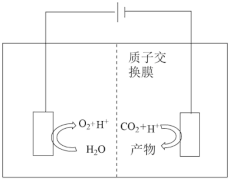
若阴极产物为HCOOH,则该电极反应式为___________ 。
(1)大气中的二氧化碳主要来自于煤、石油及其他含碳化合物的燃烧。已知25 ℃时,相关物质的燃烧热数据如表:
| 物质 | H2(g) | C(石墨,s) | C6H6(l) |
| 燃烧热ΔH(kJ·mol-1) | -285 | -393 | -3 267 |
Ⅰ.利用CO2制备CO
(2)CO2(g)+H2(g)
①这段时间内以H2O(g)表示的化学反应速率为
②求该反应的平衡常数
③下列事实能说明上述反应达到化学平衡状态的是
A.体系内
C.体系内密度不再发生变化 D.体系内CO的物质的量分数不再发生变化
Ⅱ.利用
一定条件下,向恒容密闭容器中通入一定量的
主反应:CO2(g)+3H2(g)
副反应:CO2(g)+H2(g)
已知:将CO2与H2按照一定流速通过催化剂反应,测得CO2的转化率与产物的选择性[CH3OH选择性=

(3)340℃下,原料气通入10molCO2和一定量H2相同流速通过催化剂反应,出口处测得气体中n(CO)=
(4)由图可知,随着温度的升高,
Ⅲ.利用
(5)电催化还原CO2生成含碳产物(如CO、HCOOH等)原理如图所示:

若阴极产物为HCOOH,则该电极反应式为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网