解答题-结构与性质 较难0.4 引用1 组卷292
中国较早时期就有炼铜、炼锌技术的记录,铜、锌元素也是人体必需的微量元素之一。回答下列问题:
(1)基态Cu原子核外的最高能层符号是___ ,基态Zn价电子排布式为___ 。
(2)硫酸铜溶于氨水形成[Cu(NH3)4]SO4溶液,组成[Cu(NH3)4]SO4的元素中,除Cu外其余元素的电负性由大到小排序为___ 。
(3)向[Cu(NH3)4]SO4溶液中逐滴滴加NaOH溶液,未出现浑浊,其原因是___ 。
(4)ZnO与ZnS结构相似,ZnO的熔点为1975℃,ZnS的熔点约为1700℃。ZnO熔点比ZnS高的原因是___ 。
(5)[Zn(CN)4]2-发生反应:4HCHO+[Zn(CN)4]2-+4H++4H2O=[Zn(H2O)4]2++4HOCH2CN
①HOCH2CN分子中碳原子轨道的杂化类型是___ 。
②与H2O分子互为等电子体的阴离子为___ 。
③[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键,不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为___ 。
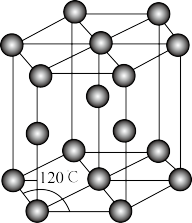
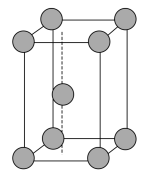
(6)金属锌晶体的晶胞如图所示,若锌原子的半径为rnm,则金属锌晶体的空间利用率是___ (用含π的代数式表示)。
(1)基态Cu原子核外的最高能层符号是
(2)硫酸铜溶于氨水形成[Cu(NH3)4]SO4溶液,组成[Cu(NH3)4]SO4的元素中,除Cu外其余元素的电负性由大到小排序为
(3)向[Cu(NH3)4]SO4溶液中逐滴滴加NaOH溶液,未出现浑浊,其原因是
(4)ZnO与ZnS结构相似,ZnO的熔点为1975℃,ZnS的熔点约为1700℃。ZnO熔点比ZnS高的原因是
(5)[Zn(CN)4]2-发生反应:4HCHO+[Zn(CN)4]2-+4H++4H2O=[Zn(H2O)4]2++4HOCH2CN
①HOCH2CN分子中碳原子轨道的杂化类型是
②与H2O分子互为等电子体的阴离子为
③[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键,不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为
(6)金属锌晶体的晶胞如图所示,若锌原子的半径为rnm,则金属锌晶体的空间利用率是

2021·四川眉山·模拟预测
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网