填空题 适中0.65 引用3 组卷741
目前新能源技术被不断利用,高铁电池技术就是科研机构着力研究的一个方向。
(1)高铁酸钾—锌电池(碱性介质)是一种典型的高铁电池,则该种电池负极材料是___________ 。
(2)工业上常采用NaClO氧化法生产高铁酸钾(K2FeO4),K2FeO4在碱性环境中稳定,在中性和酸性条件下不稳定。反应原理为:
Ⅰ.在碱性条件下,利用NaClO氧化Fe(NO3)3制得Na2FeO4:3NaClO+2Fe(NO3)3+10NaOH=2Na2FeO4+3NaCl+6NaNO3+5H2O
Ⅱ.Na2FeO4与KOH反应生成K2FeO4,主要的生产流程如下:
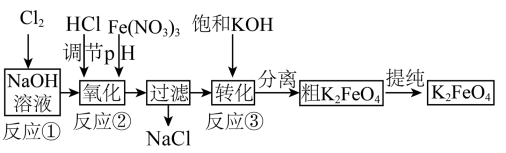
①写出反应①的离子方程式___________ 。
②请写出生产流程中“转化”(反应③)的化学方程式___________ 。
③该反应是在低温下进行的,说明此温度下Ksp(K2FeO4)___________ Ksp(Na2FeO4)(填“>”“<”或“=”)。
④“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用___________ 溶液。
a.H2O B.CH3COONa、异丙醇 C.NH4Cl、异丙醇 D.Fe(NO3)3、异丙醇
(3)已知K2FeO4在水溶液中可以发生:4 +10H2O
+10H2O 4Fe(OH)3+8OH-+3O2↑,则K2FeO4可以在水处理中的作用是
4Fe(OH)3+8OH-+3O2↑,则K2FeO4可以在水处理中的作用是___________ 。
(4) 在水溶液中的存在形态图如图所示。
在水溶液中的存在形态图如图所示。
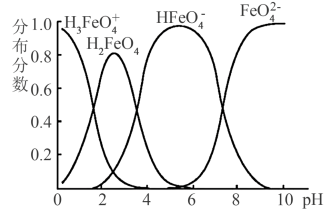
①若向pH=10的这种溶液中加硫酸至pH=2,HFeO 的分布分数的变化情况是
的分布分数的变化情况是___________ 。
②若向pH=6的这种溶液中滴加KOH溶液,则溶液中含铁元素的微粒中,___________ 转化为___________ 。(填化学式)
(1)高铁酸钾—锌电池(碱性介质)是一种典型的高铁电池,则该种电池负极材料是
(2)工业上常采用NaClO氧化法生产高铁酸钾(K2FeO4),K2FeO4在碱性环境中稳定,在中性和酸性条件下不稳定。反应原理为:
Ⅰ.在碱性条件下,利用NaClO氧化Fe(NO3)3制得Na2FeO4:3NaClO+2Fe(NO3)3+10NaOH=2Na2FeO4+3NaCl+6NaNO3+5H2O
Ⅱ.Na2FeO4与KOH反应生成K2FeO4,主要的生产流程如下:

①写出反应①的离子方程式
②请写出生产流程中“转化”(反应③)的化学方程式
③该反应是在低温下进行的,说明此温度下Ksp(K2FeO4)
④“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用
a.H2O B.CH3COONa、异丙醇 C.NH4Cl、异丙醇 D.Fe(NO3)3、异丙醇
(3)已知K2FeO4在水溶液中可以发生:4
(4)

①若向pH=10的这种溶液中加硫酸至pH=2,HFeO
②若向pH=6的这种溶液中滴加KOH溶液,则溶液中含铁元素的微粒中,
2021·新疆克拉玛依·三模
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


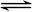 4Fe(OH)3+8OH—+3O2↑。在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用
4Fe(OH)3+8OH—+3O2↑。在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用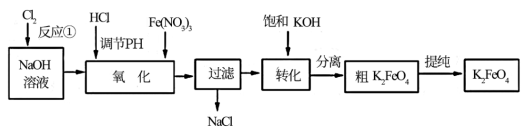


 4Fe(OH)3+8OH-+3O2↑。
4Fe(OH)3+8OH-+3O2↑。

