填空题 适中0.65 引用2 组卷206
按要求填空:
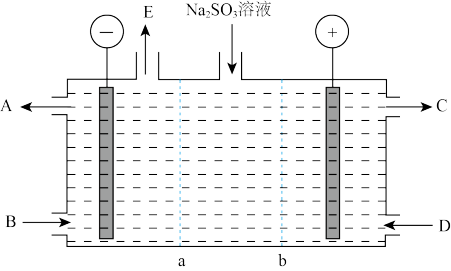
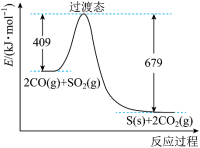
(1)对烟道气中的SO2进行回收再利用具有较高的社会价值和经济价值。CO还原法:一定条件下由SO2和CO反应生成S和CO2的能量变化如图所示,若反应中有48g S(s)生成,则该反应___________ (填“放出”或“吸收”)的热量为___________ 。
(2)汽车尾气中排放的NOx和CO污染环境,在汽车尾气中安装催化转化器,可有效降低NOx和CO的排放。已知:
a.2CO(g)+O2(g) 2CO2(g) ∆H=-566.0kJ·mol-1
2CO2(g) ∆H=-566.0kJ·mol-1
b.N2(g)+O2(g) 2NO(g) ∆H=+180.5kJ·mol-1
2NO(g) ∆H=+180.5kJ·mol-1
回答下列问题
①CO的燃烧热为___________ 。
②CO将NO还原为N2的热化学方程式为___________ 。
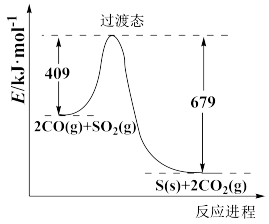
(3)电解法处理氮氧化物废气有较高的环境效益和经济效益(图中电极均为石墨)。电解NO2制备NH4NO3原理如图所示。阳极为___________ (填“X”或“Y”),Y的电极反应式为___________ 。
(1)对烟道气中的SO2进行回收再利用具有较高的社会价值和经济价值。CO还原法:一定条件下由SO2和CO反应生成S和CO2的能量变化如图所示,若反应中有48g S(s)生成,则该反应

(2)汽车尾气中排放的NOx和CO污染环境,在汽车尾气中安装催化转化器,可有效降低NOx和CO的排放。已知:
a.2CO(g)+O2(g)
b.N2(g)+O2(g)
回答下列问题
①CO的燃烧热为
②CO将NO还原为N2的热化学方程式为
(3)电解法处理氮氧化物废气有较高的环境效益和经济效益(图中电极均为石墨)。电解NO2制备NH4NO3原理如图所示。阳极为

21-22高二上·安徽宿州·期中
类题推荐
请回答下列问题:
(1)对烟道气中的SO2进行回收再利用具有较高的社会价值和经济价值。CO还原法:一定条件下,由SO2和CO反应生成S和CO2的能量变化如图所示,每生成16g S(s),该反应_______ (填“放出”或“吸收”)的热量为_______ kJ。_______ 。
(3)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25℃、101kPa下,已知该反应每转移1mole-,放热44.4kJ,写出该反应的热化学方程式_______ 。
(4)近年来空气污染日益严重,原因之一是汽车尾气中含有NO、NO2、CO等气体。为消除汽车尾气的污染,可采取:NO和CO在催化转换器中发生如下反应:2NO(g)+2CO (g)=2CO2(g)+N2(g) H1 ;
H1 ;
已知:2NO(g)+O2 (g)=2NO2(g) H2 ;
H2 ;
CO的燃烧热为 H3;
H3;
NO2与CO发生反应的热化学方程式:2NO2(g)+4CO (g)=4CO2(g)+N2(g) H =
H = _______ (用 H1、
H1、 H2、
H2、 H3表示)。
H3表示)。
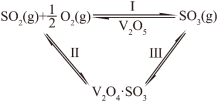
(5)工业上接触法生产硫酸的主要反应之一是:在一定的温度、压强和钒催化剂存在的条件下,SO2被空气中的O2氧化为SO3.V2O5是钒催化剂的活性成分,郭汗贤等提出:V2O5在对反应Ⅰ的催化循环过程中,经历了Ⅱ、Ⅲ两个反应阶段,图示如下:
①由此计算反应Ⅰ的 H =
H = _______ kJ/mol。
②反应Ⅱ、Ⅲ的化学方程式为_______ 、_______ 。
(1)对烟道气中的SO2进行回收再利用具有较高的社会价值和经济价值。CO还原法:一定条件下,由SO2和CO反应生成S和CO2的能量变化如图所示,每生成16g S(s),该反应
(3)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25℃、101kPa下,已知该反应每转移1mole-,放热44.4kJ,写出该反应的热化学方程式
(4)近年来空气污染日益严重,原因之一是汽车尾气中含有NO、NO2、CO等气体。为消除汽车尾气的污染,可采取:NO和CO在催化转换器中发生如下反应:2NO(g)+2CO (g)=2CO2(g)+N2(g)
已知:2NO(g)+O2 (g)=2NO2(g)
CO的燃烧热为
NO2与CO发生反应的热化学方程式:2NO2(g)+4CO (g)=4CO2(g)+N2(g)
(5)工业上接触法生产硫酸的主要反应之一是:在一定的温度、压强和钒催化剂存在的条件下,SO2被空气中的O2氧化为SO3.V2O5是钒催化剂的活性成分,郭汗贤等提出:V2O5在对反应Ⅰ的催化循环过程中,经历了Ⅱ、Ⅲ两个反应阶段,图示如下:
| 化学键 | S=O (SO2) | O=O (O2) | S=O (SO3) |
| 能量/kJ | 535 | 496 | 472 |
②反应Ⅱ、Ⅲ的化学方程式为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网