解答题-原理综合题 适中0.65 引用1 组卷26
甲醚(CH3OCH3)是重要的化工原料,可用CO和H2制得,总反应的热化学方程式如为 2CO (g) +4H2(g)  CH3OCH3 (g) + H2O (g) ΔH = -206.0 kJ/mol
CH3OCH3 (g) + H2O (g) ΔH = -206.0 kJ/mol
该过程可分为以下两步反应完成:
ⅰ.甲醇合成反应:
ⅱ.甲醇脱水反应:2CH3OH(g) CH3OCH3(g)+ H2O(g) ΔH = -24.0 kJ/mol
CH3OCH3(g)+ H2O(g) ΔH = -24.0 kJ/mol
(1)起始时向容器中投入2mol CO和4mol H2,测得某时刻上述总反应中放出的热量为51.5kJ,此时CO的转化率为___________ 。
(2)请写出甲醇合成反应的热化学方程式:___________ 。
(3)在一定条件下,将CO和H2按体积比1:2充入恒容 密闭容器中,反应生成CH3OCH3 (g)和H2O(g)。下列能说明该反应达到平衡状态的是___________(填字母)。
(4)生产甲醚的过程中还存在以下副反应,与甲醇脱水反应形成竞争:CH3OH(g) + H2O(g)  CO2(g) +3H2(g) ΔH = +48.8 kJ/mol,将反应物混合气按进料比n(CO)∶n(H2) = 1:2通入反应装置,选择合适的催化剂。在不同温度和压强下,测得甲醚的选择性分别如图1、图2所示。
CO2(g) +3H2(g) ΔH = +48.8 kJ/mol,将反应物混合气按进料比n(CO)∶n(H2) = 1:2通入反应装置,选择合适的催化剂。在不同温度和压强下,测得甲醚的选择性分别如图1、图2所示。

资料:甲醚的选择性是指转化为甲醚的CO在全部CO反应物中所占的比例。
① 图1中,温度一定,压强增大,甲醚选择性增大的原因___________ 。
② 图2中,温度高于265℃后,甲醚选择性降低的原因___________ 。
该过程可分为以下两步反应完成:
ⅰ.甲醇合成反应:
ⅱ.甲醇脱水反应:2CH3OH(g)
(1)起始时向容器中投入2mol CO和4mol H2,测得某时刻上述总反应中放出的热量为51.5kJ,此时CO的转化率为
(2)请写出甲醇合成反应的热化学方程式:
(3)在一定条件下,将CO和H2按体积比1:2充入
| A.混合气体的总物质的量保持不变 |
| B.混合气体的密度保持不变 |
| C.CH3OCH3(g)和H2O(g)的物质的量之比保持不变 |
| D.每生成1mol CH3OCH3(g),同时生成2mol CO |

资料:甲醚的选择性是指转化为甲醚的CO在全部CO反应物中所占的比例。
① 图1中,温度一定,压强增大,甲醚选择性增大的原因
② 图2中,温度高于265℃后,甲醚选择性降低的原因
21-22高二上·北京大兴·期中
类题推荐
二甲醚(CH3OCH3)是重要的化工原料,可用CO和H2制得,总反应的热化学方程式为:
工业中采用“一步法”,通过复合催化剂使下列甲醇合成和甲醇脱水反应同时进行:
i.甲醇合成反应:___________
ii.甲醇脱水反应: ,
,
(1)起始时向容器中投入2molCO和4molH2,测得某时刻上述总反应中放出的热量为51.5kJ,此时CO的转化率为___________ 。
(2)请补全甲醇合成反应 的热化学方程式___________ 。
(3)甲醇脱水反应: ,是制备二甲醚的重要环节。
,是制备二甲醚的重要环节。
①某温度下,该反应的化学平衡常数是360。在恒容密闭容器中加入一定量的CH3OH(g),测得某时刻各组分浓度如下表所示。此时正反应速率___________ 逆反应速率(填“>”、“<”或“=”)。
②在一定温度下的恒容密闭容器中发生甲醇脱水反应,下列能说明该反应已达到平衡状态的是___________ 。
a.相同时间内消耗CH3OH的物质的量与消耗CH3OCH3的物质的量之比为2:1
b.混合体系内各组分浓度不变
c.恒容密闭容器内的压强不变
(4)生产二甲醚的过程中存在以下副反应,与甲醇脱水反应形成竞争。

将反应物混合气按进料比 通入反应装置,选择合适的催化剂。在不同温度下,反应相同时间,测得二甲醚的
通入反应装置,选择合适的催化剂。在不同温度下,反应相同时间,测得二甲醚的选择性 如图所示。
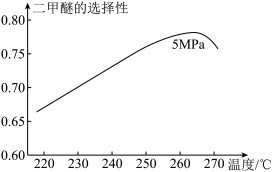
资料:二甲醚的选择性 是指转化为二甲醚的CO在全部转化的CO中所占的比例。温度低于265℃时,随着温度升高二甲醚选择性增加,原因是___________ 。
工业中采用“一步法”,通过复合催化剂使下列甲醇合成和甲醇脱水反应同时进行:
i.甲醇合成反应:___________
ii.甲醇脱水反应:
(1)起始时向容器中投入2molCO和4molH2,测得某时刻上述总反应中放出的热量为51.5kJ,此时CO的转化率为
(2)请补全
(3)甲醇脱水反应:
①某温度下,该反应的化学平衡常数是360。在恒容密闭容器中加入一定量的CH3OH(g),测得某时刻各组分浓度如下表所示。此时正反应速率
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol/L) | 0.02 | 0.4 | 0.4 |
a.相同时间内消耗CH3OH的物质的量与消耗CH3OCH3的物质的量之比为2:1
b.混合体系内各组分浓度不变
c.恒容密闭容器内的压强不变
(4)生产二甲醚的过程中存在以下副反应,与甲醇脱水反应形成竞争。
将反应物混合气按进料比

资料:二甲醚的
工业合成氨是人类科学技术的一项重大突破。其合成原理为:N2(g)+3H2(g) 2NH3(g) ΔH<0.
2NH3(g) ΔH<0.
(1)在恒温恒容密闭容器中进行合成氨的反应,下列能说明该反应已达到平衡状态的___________。
(2)恒温下,往一个4 L的密闭容器中充入2 mol N2和5.2 mol H2,反应过程中对NH3的浓度进行检测,得到的数据如表所示:
①10 min时用N2表示的平均反应速率为___________ mol·L-1·min-1.此条件下该反应的化学平衡常数K=___________ 。
②已知:N2(g)+3H2(g) 2NH3(g) ΔH=-92 kJ·mol-1
2NH3(g) ΔH=-92 kJ·mol-1
N2(g)+O2(g)=2NO(g) ΔH=+181 kJ·mol-1
2H2(g)+O2(g)=2H2O(g) ΔH=-484 kJ·mol-1
写出氨气催化氧化生成NO和水蒸气的热化学方程式___________ 。
(3)甲醚(CH3OCH3)是重要的化工原料,可用CO和H2制得,总反应的热化学方程式如为2CO(g)+4H2(g) CH3OCH3(g)+H2O(g) ΔH=-206.0 kJ·mol-1①。
CH3OCH3(g)+H2O(g) ΔH=-206.0 kJ·mol-1①。
该过程可分为以下两步反应完成:
ⅰ.甲醇合成反应:
ⅱ.甲醇脱水反应:2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH=-24.0 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH=-24.0 kJ·mol-1
起始时向容器中投入2 mol CO和4 mol H2,测得某时刻上述总反应中放出的热量为51.5 kJ,此时CO的转化率为___________ 。
(4)请写出甲醇合成反应的热化学方程式:___________ 。
(5)在一定条件下,将CO和H2按体积比1∶2充入恒容 密闭容器中,反应生成CH3OCH3(g)和H2O(g)。下列能说明该反应达到平衡状态的是___________(填字母)。
(1)在恒温恒容密闭容器中进行合成氨的反应,下列能说明该反应已达到平衡状态的___________。
| A.容器内N2、H2、NH3的浓度之比为1∶3∶2 |
| B.N2百分含量保持不变 |
| C.容器内压强保持不变 |
| D.混合气体的密度保持不变 |
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol·L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
②已知:N2(g)+3H2(g)
N2(g)+O2(g)=2NO(g) ΔH=+181 kJ·mol-1
2H2(g)+O2(g)=2H2O(g) ΔH=-484 kJ·mol-1
写出氨气催化氧化生成NO和水蒸气的热化学方程式
(3)甲醚(CH3OCH3)是重要的化工原料,可用CO和H2制得,总反应的热化学方程式如为2CO(g)+4H2(g)
该过程可分为以下两步反应完成:
ⅰ.甲醇合成反应:
ⅱ.甲醇脱水反应:2CH3OH(g)
起始时向容器中投入2 mol CO和4 mol H2,测得某时刻上述总反应中放出的热量为51.5 kJ,此时CO的转化率为
(4)请写出甲醇合成反应的热化学方程式:
(5)在一定条件下,将CO和H2按体积比1∶2充入
| A.混合气体的总物质的量保持不变 |
| B.混合气体的密度保持不变 |
| C.CH3OCH3(g)和H2O(g)的物质的量之比保持不变 |
| D.每生成1 mol CH3OCH3(g),同时生成2 mol CO |
含碳物质在日常生活极为常见,它们之间的相互转化在化学工业中有着广泛的应用。
I.一种熔融碳酸盐燃料电池原理示意如下图所示
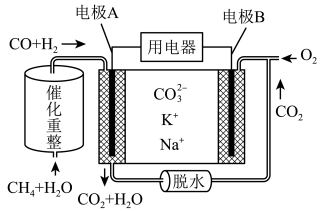
(1)写出电极A中发生的电极方程式:______ 、______ ;
II.二甲醚( )是重要的化工原料,可用CO和制得,总反应的热化学方程式如下:
)是重要的化工原料,可用CO和制得,总反应的热化学方程式如下:

工业中采用“一步法”,通过复合催化剂使下列甲醇合成和甲醇脱水反应同时进行:
i.甲醇合成反应:

ii.

(2)起始时向容器中投入2.5molCO和4mol 测得某时刻上述总反应中放出的热量为154.5kJ,此时CO的转化率为
测得某时刻上述总反应中放出的热量为154.5kJ,此时CO的转化率为___________ ;
(3)计算甲醇合成反应的
___________  ;
;
(4)甲醇脱水反应 在某温度下的化学平衡常数为400。此温度下,在某体积为2L的恒容密闭容器中加入一定量的
在某温度下的化学平衡常数为400。此温度下,在某体积为2L的恒容密闭容器中加入一定量的 ,测得某时刻各组分物质的量如下表所示。此时反应
,测得某时刻各组分物质的量如下表所示。此时反应___________ (填“朝正向进行”、“处于平衡状态”或“朝逆向进行”)。
(5)生产二甲醚的过程中存在以下副反应,与甲醇脱水反应形成竞争:
iii.

将反应物混合气按进料比 通入反应装置,选择合适的催化剂。在一定温度和压强下,测得二甲醚的选择性分别如图1、图2所示(不考虑催化剂失活)。
通入反应装置,选择合适的催化剂。在一定温度和压强下,测得二甲醚的选择性分别如图1、图2所示(不考虑催化剂失活)。
资料:二甲醚的选择性是指转化为二甲醚的CO在全部CO反应物中所占的比例。
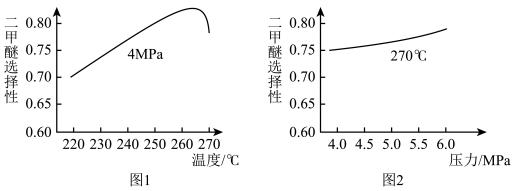
①图1中,温度高于265℃后,二甲醚选择性降低的原因是___________ 。
②图2中,温度一定,压强增大,二甲醚选择性增大的原因是___________ 。
I.一种熔融碳酸盐燃料电池原理示意如下图所示

(1)写出电极A中发生的电极方程式:
II.二甲醚(
工业中采用“一步法”,通过复合催化剂使下列甲醇合成和甲醇脱水反应同时进行:
i.甲醇合成反应:
ii.
(2)起始时向容器中投入2.5molCO和4mol
(3)计算甲醇合成反应的
(4)甲醇脱水反应
| 物质 | |||
| 物质的量/(mol) | 0.02 | 0.4 | 0.4 |
iii.
将反应物混合气按进料比
资料:二甲醚的选择性是指转化为二甲醚的CO在全部CO反应物中所占的比例。

①图1中,温度高于265℃后,二甲醚选择性降低的原因是
②图2中,温度一定,压强增大,二甲醚选择性增大的原因是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


